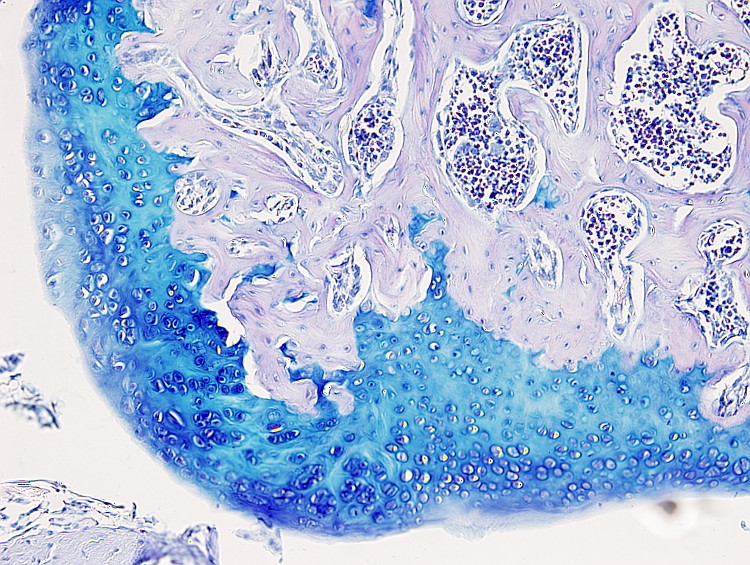
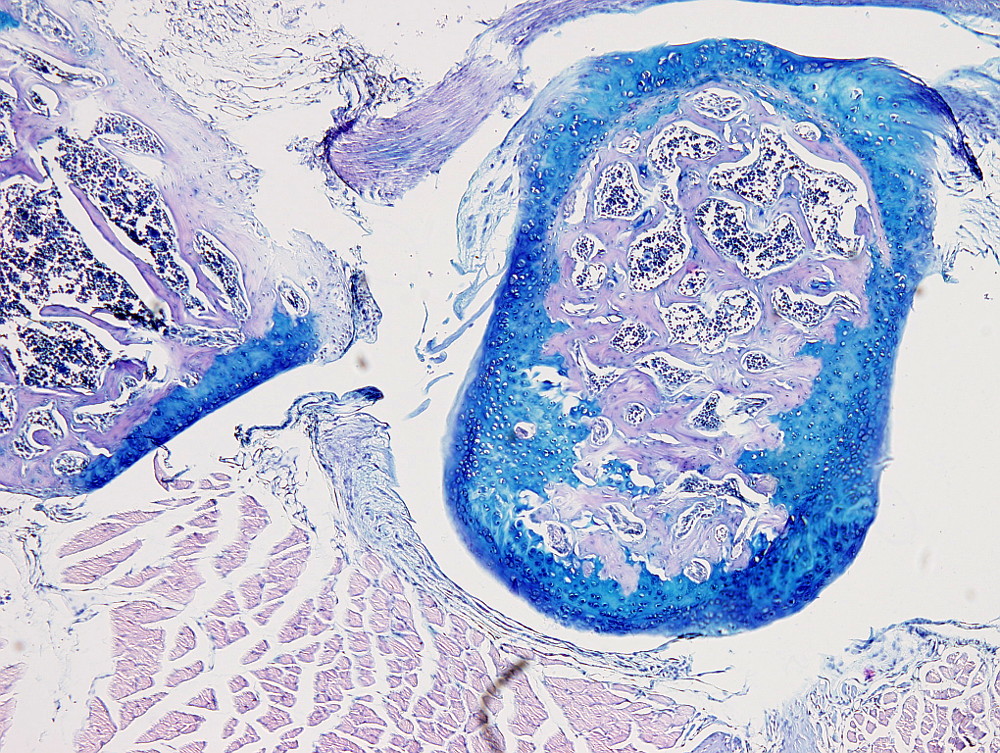
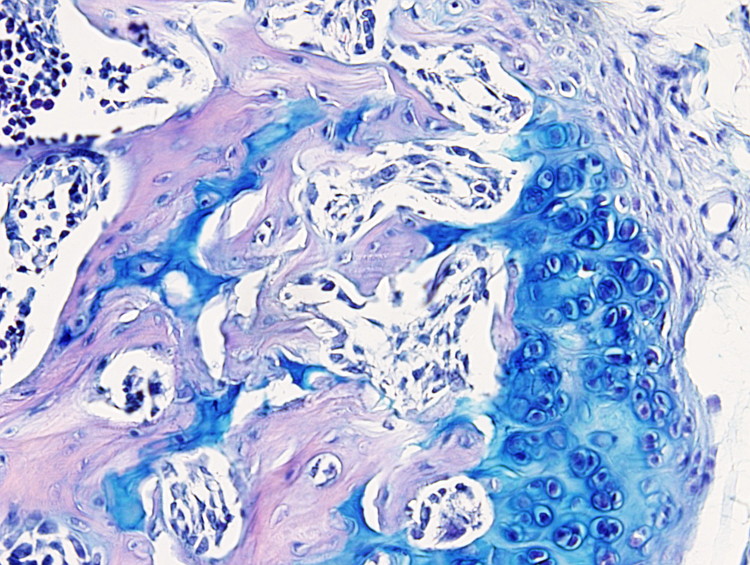
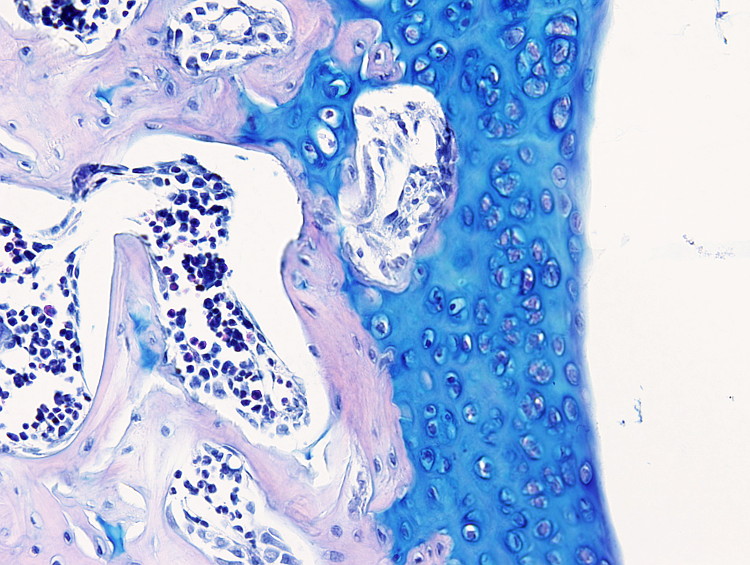
Este protocolo es útil para poner de manifiesto el cartílago y es especialmente útil para diferenciar cartílago hialino articular de hueso, puesto que la matriz extracelular cartilaginosa se tiñe con el azul alcián. Pero también se usa para teñir células mucosas como las del epitelio digestivo o las de las glándulas mucosas de las glándulas salivales.
Procedimiento
Protocolo modificado por Elisa Inés Sánchez
Partimos de muestras que han sido fijadas e incluidas en parafina. Estas muestras se han cortado en secciones de unas 8 µm y se han adherido a portaobjetos recubiertos con gelatina.
1. 2x10 min en xileno para desparafinar
2. 2x10 min en etanol 100º
3. 10 min en etanol 96º
4. 10 min en etanol 80º
5. 10 min en etanol 50º
6. 5 min en H2O destilada
7. 15 min en Azul Alcián pH 2.5
Preparación de la solución:
Azul alcián (CI 74240) 1g + ácido acético 3 ml, completar hasta 100 ml en agua destilada.
8. 15 min en H2O destilada
9. 5-10 min en Hematoxilina de Mayer
10. 15 min en agua corriente. Diferenciación.
11. 2x5 min en H2O destilada
12. 1 a 2 min en Eosina al 0.2 % en agua destilada.
La eosina, colorante ácido, se une a elementos del citoplasma y de la matriz extracelular.
Se pueden usar tres tipos de eosina: eosina amarillenta (CI 45380), eosina azulada (CI 45400) y eosina soluble en alcohol (CI
45386). La primera es la más usada.
13. Tiempo variable en 70º para diferenciación
El tiempo de diferenciación depende de la intensidad de la tinción con eosina que queramos en nuestra muestra. Se le pueden añadir unas gotas de acético.
14. 5 min en etanol 96º
15. 2x10 min en etanol 100º
16. 2x10 min en xileno
17. Montado con medio de montaje
Resultados
Citoplasma: rosado.
Núcleos: azul intenso.
Cartílago: azul intenso.
Glándulas mucosas: azul intenso.
Mastocitos: citoplasma azulado.
Consejos
El pH del Azul alcián debe ser 2.5, comprobar siempre antes de usarlo.
Hay que tener en cuenta que la tinción con azul alcián es progresiva por lo que el tiempo de tinción se podrá ajustar a cada tejido. Por ejemplo, una coloración óptima para cartílago articular puede ser de uno 10 minutos.
Los fijadores ácidos dan mejores resultados para la eosina, mientras que los fijadores que contienen ácido pícrico favorecen una mejor tinción general. Los procesos de descalcificación provocan una pobre tinción nuclear.
La eosina es muy soluble en agua. Una tinción excesiva se puede disminuir con lavados prolongados en agua.
Si el xileno se vuelve lechoso tras la deshidratación es porque la deshidratación no ha sido completa. Si esto ocurre, se han de poner limpios el último alcohol de 100º y el paso de xileno estropeado, volver las secciones al alcohol de 50º y deshidratar de nuevo.
Aunque la hematoxilina de Mayer es comúnmente usada, se pude cambiar por otros tipos de hematoxilina (ver recetas).
Productos
Xileno
Etanol de 50º, 70º, 80º, 90º, 96º y 100º
Azul alcián (CI 74240)
Hematoxilina de Mayer
Eosina acuosa al 0.2%
Ácido acético
H2O destilada
H2O corriente
Medio de montaje
Material
Cubetas de tinción
Cesta para portas
Cubreobjetos