Hay técnicas histológicas que emplean proteínas, como las lectinas o las inmunoglobulinas, para detectar a otras moléculas presentes en los tejidos con una alta especificidad. Ello es posible gracias a la capacidad que tienen estas proteínas para reconocer y unirse sólo a un tipo de molécula presente en el tejido. Las lectinas son capaces de detectar distintos tipos de glúcidos de manera específica. En muchos textos la técnica de las lectinas se incluye dentro del apartado de la histoquímica.
Las lectinas son proteínas que tienen dominios o secuencias de aminoácidos que son capaces de reconocer y unirse a glúcidos terminales que forman parte de cadenas de oligosacáridos, bien libres o formando parte de otras moléculas como las glicoproteínas. Por ello se dice que las lectinas reconocen glicoconjugados. Las lectinas son proteínas que están ampliamente distribuidas en los tejidos animales y vegetales, donde realizan funciones muy variadas. Por ejemplo, la salida de los linfocitos desde el torrente sanguíneo hacia los tejidos dañados se produce gracias a la acción de una familia de lectinas denominadas selectinas que expresan las células endoteliales próximas al lugar de la lesión. Es decir, el linfocito puede cruzar la pared endotelial gracias a la unión de las selectinas endoteliales a los glúcidos de la membrana del linfocito. En el laboratorio de histología las lectinas se usan para estudiar la distribución tisular de distintos tipos de azúcares de manera específica. Se pueden usar diferentes tipos de lectinas en base a su especificidad de reconocimiento de azúcares determinados. Hay al menos cinco grupos de lectinas según se unan a manosa (Man), a galactosa/n-acetilgalactosamina (Gal/GalNAc), a N- acetilglucosamina (GlcNAc), a fucosa (Fuc) o a ácido siálico (Neu5Ac), respectivamente.
Comercialmente hay disponibles docenas de lectinas diferentes que se nombran según el organismo animal o la planta de la que se obtienen. En la Tabla 1 se listan las lectinas usadas comúnmente según el glúcido que reconocen.
| Carbohidrato | Nombre científico | Acrónimo | Carbohidrato específico |
| Glucosa / Manosa | Galanthus nivalis Canavalia ensiformis Lens culinaris Pisum sativum |
GNA Con-A LCA PEA |
Manα1,3Man > Manα1,6Man > Manα1.2Man αMan > αGlc > GlcNAc αMan > αGlc > GlcNAc αMan > αGlc > GlcNAc |
| N-Acetilglucosamina | Griffonia simplicifolia Datura stramonium Tritricum vulgare |
GSA-II DSA WGA |
Terminal α,βGlcNAc, glucógeno Galβ1,4GlcNAc(N-acetillactosamina) > GlcNAc GlcNAc(β1,4GlcNAc)1-2 > β1,4GlcNAc1NeuAc |
| N-Acetilgalactosamina / galactosa |
Dolichus biflorus Helix pomatia Arachis hypogaea Ricinus communis |
DBA HPA PNA RCA-I |
GalNAcα1,3GalNAc > αGalNAc GalNAcα1,3GalNAc > αGalNAc Terminal Galβbe1,3GalNAc Terminal βGal > αGal > GalNAc |
| L-Fucosa |
Aleuria aurantia Lotus tetragonolobus Ulex europaeus |
AAA LTA UEA-I |
αL-Fuc αL-Fuc > αL-Fuc1,2Galβ1,4GlcNAc > L-Fucα1,2Galβ1,3GlcNAc αL-Fuc |
| ácido siálico |
Maackia amurensis Sambucus nigra |
MAA SNA |
NeuAcα2,3Galβ1,4GlcNAc NeuAcα2,6Gal = NeuAcβ2,6GalNAc |
Tabla 1. Se muestran las lectinas más usadas junto con el carbohidrato o carbohidratos a los que se unen, las especies de donde se obtienen las lectinas que reconocen a dichos carbohidratos, los acrónimos de las lectinas y los tipos de enlaces que se reconocen específicamente por cada lectina. El símbolo > significa afinidad creciente hacia su izquierda, lo que indica que una lectina puede reconocer a un carbohidrato específico enlazado de diferentes formas con otras moléculas, pero con diferente afinidad. | |||
Para poder observar el lugar de unión específico entre la lectina y su glúcido tenemos que unir a la lectina un marcador que nos produzca una señal visible con el microscopio óptico o electrónico de transmisión. Normalmente el marcaje consiste en la unión de una enzima como la peroxidasa de rábano o la fosfatasa alcalina. Es el resultado de la reacción enzimática lo que se puede observar (Figuras 1 y 2). También se usa como marcador una molécula fluorescente que se puede observar directamente en el tejido con un microscopio de fluorescencia. Cuando la enzima o la molécula fluorescente están directamente unidas a la lectina se denomina método de detección directa y cuando se unen a la lectina mediante una molécula interpuesta se denomina detección indirecta. Las moléculas interpuestas más comunes son la biotina o anticuerpos específicos (inmunoglobulinas tipo G) obtenidos contra la lectina.
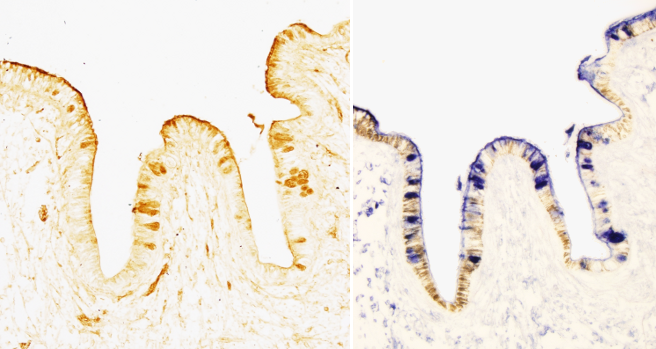
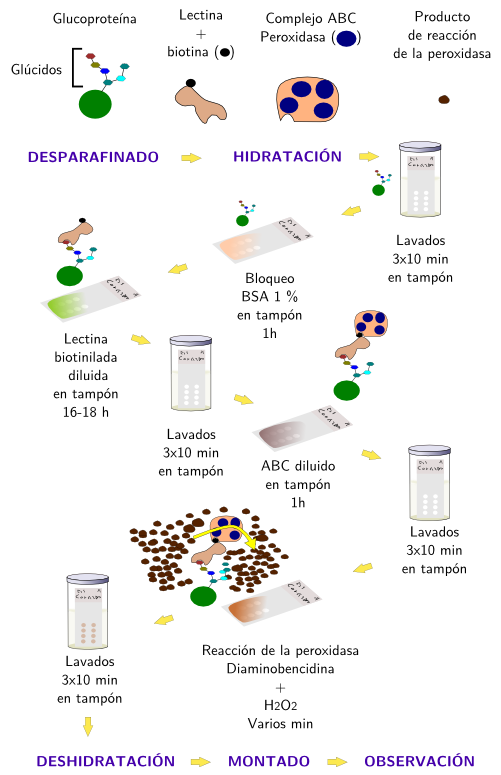
La técnica con lectinas se suele complementar con una serie de tratamientos que sirven para obtener más información acerca de la composición sacarídica de los glicoconjugados. Por ejemplo, la desulfatación se usa para demostrar las uniones tipo ésteres de sulfato de las cadenas terminales y la eliminación tipo beta permite conocer si las cadenas de glúcidos son uniones con enlaces tipo O (uniones covalentes a grupos hidroxilo) o tipo N (enlaces covalentes a grupos amino). En este último caso la alcalinización de los cortes elimina las uniones tipo O.
-
Bibliografía ↷
-
Bibliografía
Brooks SA. 2017. Lectin Histochemistry: Historical Perspectives, State of the Art, and the Future. In C. Pellicciari & M. Biggiogera (Eds.), Histochemistry of Single Molecules: Methods and Protocols (pp. 93–107). Springer. https://doi.org/10.1007/978-1-4939-6788-9_6
-
 Histoquímica
Histoquímica