La matriz extracelular de los animales está formada principalmente por proteínas, glicosaminoglicanos, proteoglicanos y glicoproteínas, organizados en entramados diversos que constituyen las diferentes matrices extracelulares de los distintos tejidos. Las proteínas estructurales más abundantes son el colágeno y la elastina.
1. Colágeno
Se denomina colágeno a una familia de proteínas muy abundante en los animales, pudiendo representar del 25 al 30 % de todas las proteínas corporales. Tradicionalmente se ha usado el colágeno para fabricar pegamentos y colas, de ahí su nombre (del griego kola: pegamento). En los vertebrados hay unos 46 genes que sintetizan unas cadenas de aminoácidos denominadas cadenas alfa, las cuales se asocian de tres en tres para formar hasta 28 tipos de moléculas de colágeno diferentes (ver tabla). La combinación de cadenas alfa puede ser homotípica (todas las cadenas iguales) o heterotípica (cadenas diferentes). La principal misión del colágeno es crear un armazón que hace de sostén a los tejidos y que resiste las fuerzas de tensión mecánica. Actúa como las barras de acero que refuerzan el hormigón en los edificios. La organización de las moléculas de colágeno en estructuras macromoleculares tridimensionales es variada, pudiendo formar haces, matrices, etcétera. Las células se "agarran" a las moléculas de colágeno mediante diversas proteínas de adhesión como las integrinas, inmunoglobulinas, anexinas, etcétera. Otras moléculas de la matriz extracelular interaccionan también con las moléculas de colágeno como proteoglicanos y glicoproteínas, trabando más toda la estructura.
Organización
Las moléculas de colágeno se caracterizan por:
a) Una composición poco frecuente de aminoácidos. En las moléculas de colágeno abunda el aminoácido glicina, y hay otros menos comunes como la hidroxilisina y la hidroxiprolina. La glicina se repite cada 3 aminoácidos (...-Gly - x - y - Gly - x - y -...), donde Gly es la glicina, y -x- e -y- suelen ser hidroxilisina e hidroxiprolina, respectivamente. Esta secuencia repetida con la glicina, y debido al pequeño tamaño de este aminoácido, es la que permite la disposición en hélice levógira de las cadenas polipetídicas formando así una estructura en hélice alfa.
b) Pueden organizarse formando fibras, mallas o especializarse en formar uniones entre moléculas. Todo ello depende de la composición química de sus subunidades alfa y de los tipos de subunidades que lo formen (ver tabla).
Forman fibras. Son las más abundantes de todas las formas de colágeno y están formadas por repeticiones alineadas de moléculas de colágeno (Figuras 1, 2 y 3). De los colágenos que forman fibras el más frecuente es el tipo I, que abunda en huesos, cartílago y piel, y que representa el 90 % de todo el colágeno del organismo. Otros tipos abundantes son el II, presente en el cartílago hialino, y el III, que abunda en la piel y en los vasos sanguíneos. Igual que hay moléculas heterotípicas (cadenas alfa diferentes), también hay fibras heterotípicas formadas por más de un tipo de colágeno. Por ejemplo, hay fibras de colágeno I que contiene también colágeno tipo III y V.
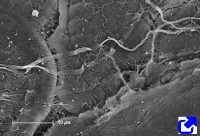
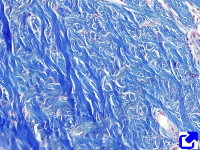
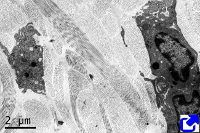
Forman mallas. Estos tipos de colágeno suelen organizarse en entramados moleculares que forman láminas. Se encuentran rodeando los órganos, rodeando células como las musculares, o formando la base de los epitelios. Entre éstos se encuentra el colágeno tipo IV que abunda en la lámina basal, localizada entre el epitelio y el tejido conectivo.
Se organizan en forma de pequeños filamentos arrosariados que se distribuyen en un entramado que ayuda a la cohesión de la matriz extracelular. Destaca el colágeno tipo VI.
Están asociados a otras fibras de colágeno y modulan la disposición, organización e interacción de dichas fibras con otros elementos de la matriz extracelular. Por ejemplo, el colágeno tipo IX forma uniones entre los glicosaminoglicanos y las fibras de colágeno tipo II.
También existen moléculas de colágeno que poseen secuencias de aminoácidos hidrofóbicos y que se encuentran como moléculas transmembrana. Es el caso de los colágenos tipo XIII y tipo XVII. Estos colágenos operan como receptores y están relacionados con la adhesión y movilidad. El colágeno tipo XVII forma parte de la estructura de los hemidesmosomas.
Síntesis
Independientemente del tipo, la síntesis de las moléculas de colágeno ocurre en forma de precursor (Figura 4). El colágeno se sintetiza en el interior celular en forma de procolágeno. En primer lugar se sintetizan las cadenas alfa inmaduras en el retículo endoplasmático, donde son modificadas. Las prolinas y lisinas son hidroxiladas para dar hidroxiprolinas e hidroxilisinas, pudiendo representar ambas hasta el 20 % de la molécula de colágeno. También se lleva a cabo la adición de sacáridos, proceso denominado glicosidación (del tipo O-glicosidación). En este momento se asocian las cadenas alfa de 3 en 3 gracias a puentes de hidrógeno y a puentes disulfuro, para formar las moléculas de procolágeno. Éstas son reconocidas por receptores transmembrana y empaquetadas en vesículas recubiertas por COPII. Estas vesículas, de unos 500 nm de diámetro, han de ser diferentes al resto de vesículas que salen del retículo endoplasmático puesto que las moléculas de procolágeno son como varillas rígidas de unos 300 nm (las vesículas típicas COPII miden entre 60 y 90 nm). El procolágeno pasa por el aparato de Golgi, no se sabe muy bien cómo, desde donde es exocitado al exterior celular. Es destacable que algunas células pueden seleccionar el dominio celular donde se liberará un determinado tipo de colágeno. Independientemente de esto, durante, o tras la liberación, las moléculas de procolágeno sufren una acción enzimática por metaloproteinasas específicas que elimina las secuencias terminales de cada cadena alfa, transformando el procolágeno en colágeno. Estas secuencias terminales impiden que el procolágeno se ensamble espontáneamente en el interior celular. Antes se pensaba que el procesamiento del procolágeno y el esamblado de las fibrillas era extracelular, pero parece que empieza antes de su completa exocitosis en compartimentos entre el aparato de Golgi y la membrana plasmática.
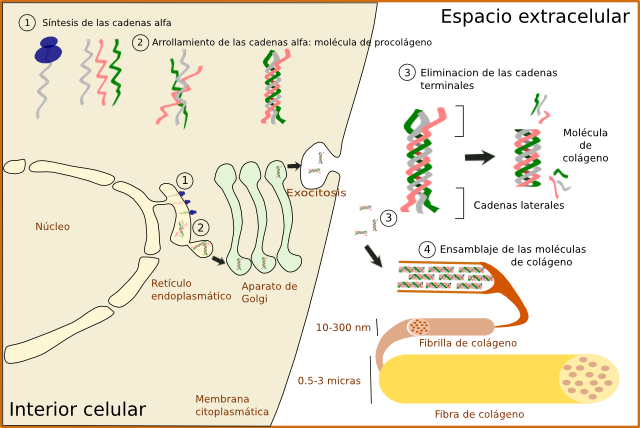
Las moléculas de colágeno, ya sin cadenas terminales, se ensamblan automáticamente para formar las fibrillas de colágeno, que a su vez se unen para formar las fibras de colágeno (Figuras 4 y 5). La formación de las fibras de colágeno, sin embargo, parece estar controlada por la participación de los colágenos tipo V y XI. En concreto el colágeno tipo V parece imprescindible para la formación final de las fibras de colágeno ya que si se elimina no se observan tales fibras. La forma y el crecimiento de las fibras de colágeno se ven afectados por otras moléculas como algunos proteoglicanos, como la decorina, fibromodulina y limicano. En la fase final de ensamblaje, y para dar estabilidad a la fibra, se forman enlaces químicos por enzimas como la lisil oxidasa.
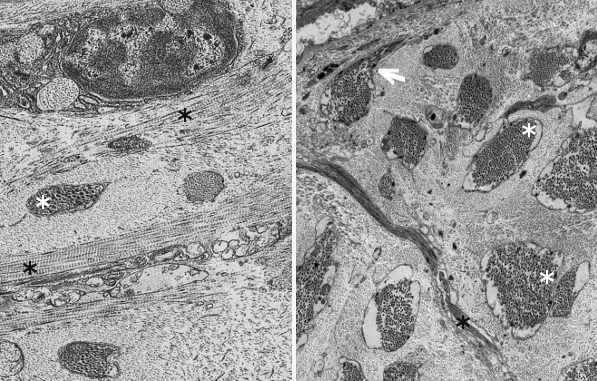
El colágeno se sintetiza principalmente por fibroblastos, miofibroblastos, osteoblastos y condrocitos. Aunque, en general, todas las células de un tejido pueden contribuir a la síntesis de matriz extracelular. Por ejemplo, algunas moléculas de colágeno son sintetizadas por las células epiteliales.
2. Fibras elásticas
La elastina es un polímero proteico insoluble abundante en muchas matrices extracelulares y es un componente de las denominadas fibras elásticas (Figuras 6 y 7). El principal componente de la elastina es la tropoelastina. Esta proteína se libera a la matriz extracelular y forma agregados amorfos entre los que se establecen enlaces químicos. La tropoelastina posee una larga cadena de aminoácidos en la que hay numerosas secuencias con aminoácidos hidrófobos, separadas por otras secuencias que contienen parejas de glicinas y otros aminoácidos pequeños como la lisina. Esta composición de aminoácidos es la que confiere las propiedades elásticas, puesto que los aminoácidos hidrófobos tienden a una disposición en estructuras arrolladas y la lisina la formación de α-hélices. De manera que en ambientes acuosos la tropoelastina adopta un disposición globular, pero que se puede estirar cuando se somete a fuerzas mecánicas. Cuando estas fuerzas desaparecen la proteína se vuelve de nuevo globular. Es decir, se comportan como un elástico Los aminoácidos no hidrófobos son los puntos donde se enlazan dos moléculas de tropelastina próximas para formar el polímero de elastina. El alto contenido en aminoácidos hidrófobos hace a la tropolastina una de las proteínas más resistentes y duraderas de la matriz extracelular. La tropoelastina parece ser una invención de los vertebrados, puesto que no se ha encontrado en invertebrados.
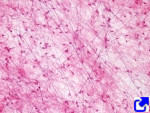
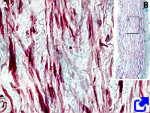
Al contrario que las fibras de colágeno, las fibras elásticas tienen la capacidad de estirarse en respuesta a las tensiones mecánicas y de contraerse para recuperar su longitud inicial en reposo gracias a las propiedades de la tropoelastina. Una fibra elástica está formada por el material amorfo de tropoelastina, que representa el 90 %, y por una cubierta formada por las denominadas microfibrillas de fibrilina y por otras glicoproteínas y proteoglicanos en menor proporción (Figura 8). La elasticidad de nuestros tejidos depende de las fibras elásticas. Estas fibras se encuentran sobre todo en la dermis, en las paredes de las arterias, en el cartílago elástico y en el tejido conectivo de los pulmones. La concentración de fibras elásticas varía entre tejidos. Por ejemplo, llega hasta el 70 % de la matriz extracelular en los ligamentos. Con el tiempo, la cantidad de fibras elásticas disminuye en los tejidos y los órganos, y estas estructuras se vuelven más rígidas, como por ejemplo los vasos sanguíneos. Además de la elasticidad, otras funciones de las fibras elásticas son aportar sostén a los tejidos o regular la actividad de los factores de crecimiento TGF-β mediado por la fibrilina.

-
Bibliografía ↷
-
Bibliografía
Heino J. 2007. The collagen family members as cell adhesion proteins. Bioessays. 29:1001-1010.
Canty EG, Kadler KE. 2005. Procollagen trafficking, processing and fibrillogenesis. Journal of cell sciences. 118:1341-1353.
Kadler KE, Baldock C, Bella J, Boot-Handford RP. 2007. Collagens at a glance. Journal of cell science. 120:1955-1958.
Kielty CM. 2006. Elastic fibres in health and disease. Expert reviews in molecular medicine. 8:1-23.
-
 Introducción
Introducción 