La matriz extracelular está formada por proteínas y glúcidos en un medio acuoso. En los tejidos animales las proteínas colágeno, las fibras elásticas y otras moléculas presentes en la matriz extracelular se encuentran embebidas en un medio compuesto fundamentalmente por polímeros no ramificados de glúcidos y agua. Los glúcidos corresponden sobre todo al tipo de los denominados glicosaminoglicanos o mucopolisacáridos. En las paredes celulares de las células vegetales no existen glicosaminoglicanos sino sobre todo celulosa, que es un polímero de glucosa.
1. Glicosaminoglicanos
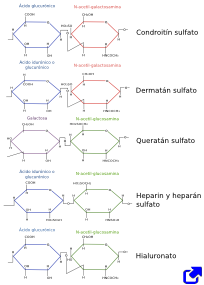
Los glicosaminoglicanos son polímeros no ramificados de azúcares que pueden formar cadenas muy largas. Están formados por repeticiones de parejas de monosacáridos donde uno de los azúcares tiene un grupo amino (N-acetilgalactosamina o N-acetilglucosamina) y el otro es normalmente la galactosa o el ácido glucurónico. Estos azúcares poseen grupos carboxilo (COO-) y pueden tener grupos sulfatos (SO3-), cuyas cargas negativas permiten una fuerte y abundante asociación con moléculas de agua, aportando una gran hidratación a la matriz extracelular (Figura 1). Los glicosaminoclicanos son moléculas poco flexibles por lo que ocupan un gran volumen y gracias a su fuerte hidratación hacen que la matriz extracelular se comporte como un gel. Esto permite que los tejidos que poseen una alta proporción de glicosaminoglicanos puedan resistir fuertes presiones mecánicas y además favorece una alta tasa de difusión de sustancias entre las célula. Los tipos más comunes de glicosaminoglicanos son el ácido hialurónico y los glicosaminoglicanos que forman proteoglicanos: condroitín sulfato, dermatán sulfato, queratán sulfato y heparán sulfato.
Ácido hialurónico
El ácido hialurónico o hialuronato es un caso especial de glicosaminoglicano puesto que no forma enlaces covalentes con otras moléculas de la matriz extracelular, se sintetiza por enzimas localizados en la membrana plasmática y no posee grupos sulfatos. Está compuesto por parejas de azúcares formadas por la N-acetil-D-glucosamina y el ácido D-glucurónico, que pueden llegar hasta las 20.000 repeticiones. Se suele asociar con las moléculas de colágeno o a proteoglicanos, confiriendo a la matriz extracelular elasticidad, resistencia y lubricación. Su función es muy importante durante el desarrollo o en lugares del organismo donde se produce una fuerte proliferación celular puesto que facilita el desplazamiento celular y difusión molecular. Al ser una molécula grande y poco flexible ocupa un volumen grande dejando muchos espacios. También aparece en aquellos lugares donde se produce una fuerte fricción como en el cartílago de las articulaciones.
Otros
Los demás tipos de glicosaminoglicanos están sulfatados y unidos covalentemente a cadenas de aminoácidos formando los denominados proteoglicanos (ver más abajo). El condroitín sulfato es un glicosaminoglicano sulfatado compuesto por repeticiones de parejas de N-acetil-galactosamina y ácido glucurónico. Es abundante en el cartílago y tejido nervioso. El dermatán sulfato está formado por ácido glucurónico o ácido idurónico más N-acetil-galactosamina. El queratán sulfato es un polímero de parejas de N-acetil-glucosamina más galactosa, con los azúcares mostrando distinto tipo de sulfatación. El heparán sulfato lo producen la mayoría de las células. Es un componente esencial de la lámina basal, donde constituye la mayor parte de ésta. Todos estos glicosaminoglicanos tienen muchas cargas negativas, lo que hace que se asocien fácilmente con otras moléculas como factores de crecimiento o quimiocinas, lamininas y fibronectinas. El derivado del heparán sulfato, la heparina, la producen los mastocitos, y en menor medida los basófilos. La heparina es un antitrombótico muy usado en medicina como anticoagulante. Está formado por dímeros de N-acetil-glucosamina más ácido glucurónico o ácido idurónico, igual que el hialuronato, pero con distintos tipos de enlaces entre azúcares, los cuales son sulfatados.
2. Proteoglicanos
Un proteoglicano es una molécula compuesta por la unión covalente entre una cadena de aminoácidos y uno o varios glicosaminoglicanos sulfatados (Figura 2). Los glicosaminoglicanos se unen a los péptidos a través de residuos del aminoácido serina. Los proteoglicanos forman una familia de moléculas ubicua en los tejidos animales y son elementos esenciales del espacio pericelular. Virtualmente todas las células son capaces de sintetizar proteoglicanos y secretarlos, dejarlos en sus membranas o almacenarlos en gránulos. Una célula es capaz de sintetizar varios tipos de proteoglicanos. Los proteoglicanos son sintetizados en el interior celular. La parte proteica se sintetiza en el retículo endoplasmático, donde también se inicia la adición de glúcidos. Sin embargo, la elongación de las cadenas de parejas repetidas de los glicosaminoglicanos y su sulfatación se producen en el lado trans del aparato de Golgi. La mayoría de los proteoglicanos son exocitados al espacio intercelular, pero algunos formarán parte de la membrana plasmática gracias a que su parte proteica contiene secuencias de aminoácidos hidrófobos que se insertan entre las cadenas de ácidos grasos de la membrana.

Los proteoglicanos se diferencian en la secuencia y en la longitud de la cadena de aminoácidos (desde 100 a 4000 aminoácidos). Relativamente pocas proteínas (o cadenas de polipéptidos) pueden tener unidos glicosaminoglicanos covalentemente (unas 17 para el heparán sulfato, 20 para condroitín/dermatán y 8 para el queratán). Ello no impide que se puedan producir una gran diversidad de proteoglicanos. Así, también se diferencian en el número y en el tipo de moléculas de glicosaminoglicanos que tiene unidos. Por ejemplo, la decorina tiene una sola cadena de glicosaminoglicano mientras que el agrecano contiene más de 200. También se diferencian en el grado de sulfatación y en la distribución de los grupos sulfatos en las cadenas de glicosoaminoglicano. Por ejemplo, el grado de sulfatación varía con la edad, tejido y patología.
Los proteoglicanos se pueden agrupar en varias familias. Los lecticanos poseen una parte proteica con un extremo amino globular que interactúa con el hialuronato, un dominio central de coindritín sulfato y otro dominio terminal que actúa como una lectina tipo C. Posee sobre todo condroitín sulfato y, a veces, queratán sulfato. Son miembros de este grupo el agrecano, versicano, neurocano y brevicano. El agrecano abunda en el cartílago, el brevicano y neurocano se expresan en tejido nervioso, y el versicano en tejido conjuntivo. El grupo denominado SLRP (“small leucine-rich proteoglycans”) se caracteriza por tener muchas repeticiones del aminoácido leucina y está unido a condroitín o dermatán sulfato y a queratán sulfato. Miembros de este grupo son la decorina, biblicano, fibromodulina o el queratocano. Una función de los proteoglicanos SLRP es estabilizar la fibras de colágeno. Un grupo importante es el formado por los proteglicanos que contienen heparán sulfato. Los proteoglicanos pueden encontrarse de tres maneras: unido a la superficie celular a través del receptor CD44v3 (como los sindecanos), unido covalentemente a los glucosil-fosfatidilinositoles de la membrana (como los glipicanos) o libres en la matriz (tales como la agrina, el colágeno tipo XVIII y el perlecán). Hay un grupo heterogéneo de proteínas entre las que se encuentran el receptor CD44, proteína precursora amiloide y algunos colágenos (IX, XII,XIV y XVIII) que pueden tener unidas o no moléculas de glicosaminoglicanos sulfatados. Es decir, serían proteoglicanos a "tiempo parcial".
La actividad biológica de los proteoglicanos depende en gran medida del peso molecular, tipos de monosacáridos que poseen y las uniones entre los disacáridos de los glicosaminoglicanos. Todos los glicosaminoglicanos tienen cargas negativas, pero la cantidad de cargas es una característica fundamental para su función. Esta carga negativa se asocia a la cantidad de grupos sulfato que posean. La variación en la posición de los grupos sulfatos hace que una misma cadena de azúcares pueda convertirse en cientos de moléculas diferentes. Las funciones generales de los proteoglicanos son: hidratación, resistencia a presiones mecánicas, lubricantes, son capaces de capturar y liberar factores de crecimiento afectando a la diferenciación, la movilidad y la fisiología celular, etcétera. Su acción mecánica es esencial en los cartílagos y en las articulaciones. Pero además son puntos de anclaje de las células a la matriz extracelular que les rodea, bien por su acción directa al ser moléculas integrales de la membrana plasmática o porque son reconocidos por proteínas de adhesión como las integrinas, presentes en las membranas plasmáticas. Es interesante resaltar que los proteoglicanos sulfatados son escasos en los nichos de las células madres.
Los proteoglicanos pueden crear una barrera pericelular física y química. Las redes perineuronales son porciones de matriz extracelular que rodean el soma y dendritas proximales de neuronas del sistema nervioso central, donde podrían participar en la plasticidad, formación de nuevas sinapsis, etcétera. Su déficit está relacionado con ciertas patologías. Estas redes son inhibidores físicos que limitan la plasticidad neuronal.
Los glicosaminoglicanos sulfatados son también lugares de secuestro de proteínas cargadas, para su posterior uso. En algunas ocasiones la interacción de los glicosaminoglicanos con las proteínas provocan un cambio de conformación de éstas últimas, llevando a su activación o inactivación. Un ejemplo, es la heparina, la cual activa a la molécula antitrombina para que una a la trombina y factor X, con lo que se evita la coagulación sanguínea. Otro ejemplo es la fibronectina, la cual tras interactuar con glicosaminoglicanos cambia su conformación y expone más dominios con los que interactuar con otras moléculas de la matriz extracelular. Otra función de los glicosaminoglicanos es actuar como correceptores, de manera que la unión al receptor aumenta la afinidad por el ligando.
3. Celulosa
La celulosa es el principal componente de las paredes vegetales, la matriz extracelular de las plantas. Aunque algunos autores consideran que la pared celular de las plantas no se puede incluir en la categoría de matriz extracelular por sus características propias, nosotros la consideraremos como un tipo muy especializado de matriz extracelular. La celulosa es una estructura paracristalina compuesta de un polisacárido formado por monómeros de glucosa (más de 500 por molécula) unidos mediante enlaces tipo β(1-4) (Figura 3, y figura ). Las cadenas de glucosa se asocian entre sí mediante enlaces de hidrógeno y fuerzas de Van der Waals para formar estructuras denominadas microfibrillas de celulosa, formadas por unas 50 moléculas de celulosa orientadas con la misma polaridad. Las microfibrillas se asocian entre sí mediante enlaces formados entre ellas y por otros glúcidos, principalmente la hemicelulosa y las pectinas, que resultan en las fibrillas y fibras de celulosa, visibles al microscopio óptico.

Al igual que ocurre con el ácido hialurónico, la celulosa se sintetiza en la membrana plasmática gracias a la acción de la celulosa sintasa, una proteína transmembrana con una secuencia de aminoácidos que cruzan 8 veces la membrana celular (Figura 4). Esta enzima recoge las unidades de glucosa desde el citosol, les hace cruzar la membrana y las enlaza en el exterior celular. Hasta 36 enzimas celulosa sintasa se unen en un punto de la membrana para formar el denominado complejo de celulosa sintasa, el cual puede sintetizar hasta 36 moléculas de glucosa simultáneamente, las cuales se van asociando en microfibrillas de celulosa conforme se van sintetizando.
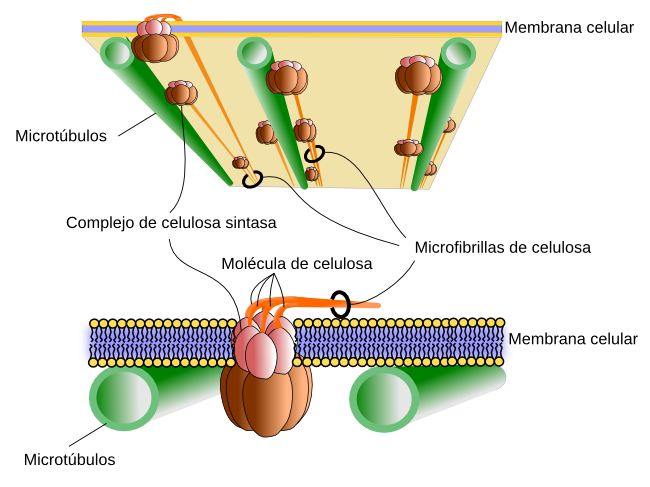
Un aspecto interesante de la síntesis de celulosa es la orientación de las moléculas que se van sintetizando, ya que determina la orientación de las microfibrillas y posteriormente de las fibras de celulosa. El crecimiento de las plantas es sobre todo por crecimiento del tamaño celular, el cual se produce por presiones hidrostáticas. Una célula crece hacia donde menos resistencia encuentre, lo cual depende de la resistencia que oponga la pared celular. La orientación de la deposición de las moléculas de celulosa condiciona esa resistencia, de manera que hay menor resistencia en la dirección perpendicular a las fibras de celulosa. La orientación de las fibras de celulosa está condicionada por los espacios por los que se puede mover la celulosa sintasa, que a su vez depende de la orientación de los microtúbulos corticales que se localizan justo debajo de la membrana plasmática, en el citosol (Figura 4). Estos microtúbulos son barreras que no pueden ser cruzadas por las enzimas sintasas de la celulosa. Estas enzimas se desplazan por las membrana a medida que van sintetizando fibrillas de celulosa pero sólo hacia donde les permiten los microtúbulos. Otros factores extracelulares e intracelulares pueden condicionar también la dirección del movimiento de estos complejos enzimáticos. De esta manera la célula puede controlar la orientación de las fibras de celulosa y por tanto su dirección de crecimiento, por ejemplo para que una estructura vegetal, tallos u hojas, crezcan hacia una fuente de luz. Además, de la orientación de las fibras de celulosa, la pared celular se hace más blanda en determinados lugares mediante la modificación química de la pectina (otro componente de la matriz extracelular) y por acidificación, y es en estos lugares donde también se encuentra menos resistencia y por tanto por donde crece la célula.
-
Bibliografía ↷
-
Bibliografía
Bosman FT, Stamenkovic I. 2003. Functional structure and composition of the extracellular matrix. Journal of pathology. 200: 423-428.
Lamoureux F. 2007. Proteoglycans: key partners in bone cell biology. BioEssays. 29: 758-771.
McFarlane HE, Döring A, Persson S. 2014. The cell biology of the cellulose synthesis. Annual review of plant biology. 65: 69-94.
Soares da Costa D, Reis RL, Pashkuleva I. 2017. Sulfation of Glycosaminoglycans and Its Implications in Human Health and Disorders. Annual review of biomedical engineering. 19: 1-26.
-
 Proteínas estructurales
Proteínas estructurales