Incluiremos dentro de las técnicas histoquímicas a aquellas que supongan una reacción química en la que intervienen moléculas pertenecientes al propio tejido (trataremos la detección de glúcidos mediante lectinas y la inmunohistoquímica en apartados diferentes a éste, aunque algunos autores las incluyen como técnicas histoquímicas). El objetivo de la histoquímica es poner de manifiesto una molécula o familia de moléculas presentes en una sección histológica y estudiar su distribución tisular "in situ". Estas moléculas son difícilmente discernibles con técnicas generales y por tanto es necesario realizar pasos previos para poner de manifiesto dichas moléculas. Vamos a dividir las técnicas histoquímicas en dos grupos: reacciones químicas e histoquímica enzimática.
1. Reacciones químicas
Las reacciones químicas consisten en la modificación química de moléculas del tejido para posteriormente poder colorearlas. Existen técnicas histoquímicas para detectar glúcidos, proteínas y nucleótidos. La técnica histoquímica más empleada es la reacción de PAS (Periodic Acid Schiff) (Figuras 1 y 2). Se utiliza para la detección de hidratos de carbono, libres o conjugados, cuando están en cantidades relativamente grandes en los tejidos. La modificación química del tejido consiste en la oxidación mediante el ácido periódico de los enlaces entre los carbonos próximos que contienen grupos hidroxilos. Esto provoca la formación de grupos aldehídos que serán reconocidos por el reactivo de Schiff, el cual se combinará con ellos para dar un color rojizo brillante (Figura 1). Entre los componentes del reactivo de Schiff está la pararosanilina (un componente de la fucsina básica) tratada con ácido sulfúrico. Una gran ventaja de la tinción histoquímica PAS es su capacidad de discriminación de tipos de glúcidos con pequeñas modificaciones de la técnica.
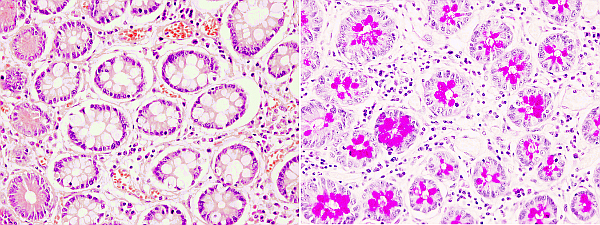
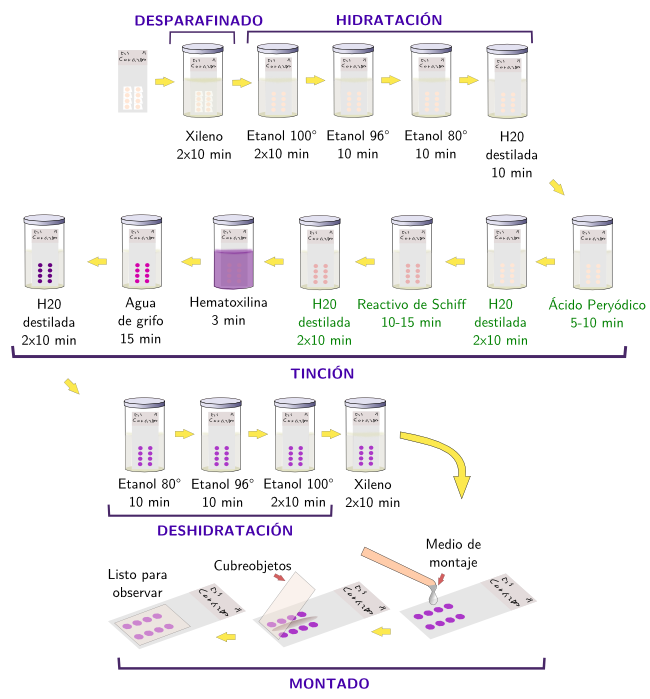
Otro tipo de elementos que pueden ser detectados mediante reacciones histoquímicos son los metales pesados. Los tejidos animales tienen diversas cantidades de metales tales pesados como el hierro, cadmio, cobalto, cobre, zinc, magnesio y otros, normalmente formando parte de las proteínas. Es necesario detectar su localización y concentración para entender la fisiología de los tejidos, pero también en casos patológicos o tras intoxicaciones por contaminación de los alimentos. Los metales se pueden demostrar en los tejidos mediante dos tipos de reacciones histoquímicas: aquellas que emplean el sulfuro de plata y aquellas que emplean quelantes. En la primera técnica los metales son convertidos en sulfuros y luego sustituidos por plata. El sulfuro de plata se reduce después a plata metálica, que es la que se observa con el microscopio. Sin embargo, esta técnica no discrimina entre algunos metales, pero es muy sensible. La segunda técnica, los agentes quelantes, los cuales compiten con las proteínas por los metales y los concentran. La propia reacción con los metales da lugar a un producto coloreado que puede observarse con el microscopio. Los quelantes son menos sensibles, pero, con modificaciones de la técnica, permiten discriminar más entre tipos de metales.
1. Reacciones enzimáticas
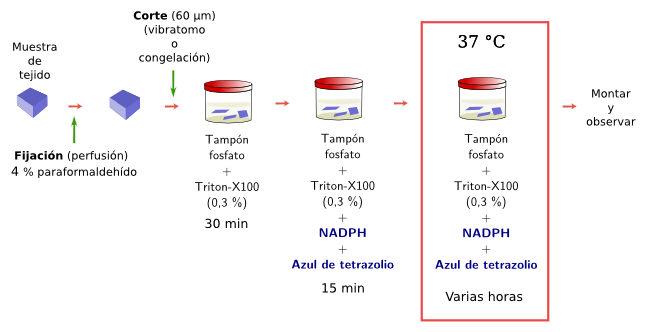
La histoquímica enzimática, o histoenzimología, se basa en la capacidad que tienen algunos enzimas del tejido de mantener funcional su centro activo tras el proceso de fijación. Estos enzimas y las células que los poseen se ponen de manifiesto mediante la adición de un sustrato que produce una reacción enzimática, que normalmente libera electrones y convierte a unas sustancias solubles e incoloras en complejos insolubles y coloreados. El sustrato es específico para cada enzima, pero las moléculas que dan color pueden usarse para varios tipos de enzimas. Las moléculas que dan color, durante la reacción enzimática, se depositan en el lugar preciso donde se produjo dicha reacción, es decir, donde se localiza el enzima. Las enzimas que se pueden detectar son variadas como las peroxidasas, fosfatasas, deshidrogenasas, diaforasas, acetilcolinesterasa, etcétera. Hay que tener en cuenta que cuando queremos detectar una actividad enzimática es recomendable no incluir el material en medios como la parafina puesto que la deshidratación y la temperatura elevada pueden dañar la conformación de la enzima y por tanto la actividad de su centro activo. Por ello estas técnicas se realizan normalmente en secciones obtenidas por congelación o con el vibratomo.
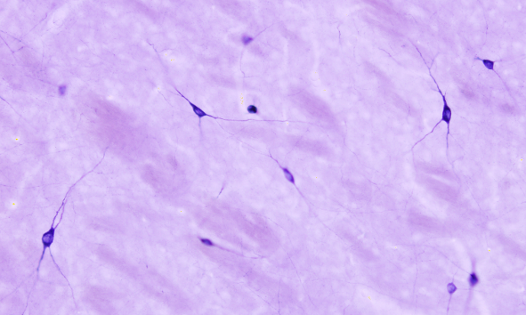
La actividad NADPH diaforasa se asocia a las enzimas sintasas del óxido nítrico en sistema nervioso y vascular (Figuras 3 y 4). A estos enzimas se les ha relacionado con el control del flujo sanguíneo y con ciertos aspectos de la fisiología del sistema nervioso. Esta técnica permite detectar neuronas que expresan la enzima sintasa del óxido nítrico de una forma sencilla y rápida. La reacción es NADPH + tetrazolio = NADP+ + formazán. Es el formazán el producto coloreado e insoluble que se puede observar con el microscopio óptico, incluso con el microscopio electrónico de transmisión.
 Tinciones generales
Tinciones generales 