1. Tipos
2. Distribución
3. Asimetría
4. Lateral
5. Síntesis
- Mitocondrias
- Cloroplatos
6. Funciones
Según la definición de “LIPID MAPS” (LIPID Metabolites And Pathways Strategy), un lípido es cualquier molécula insoluble en agua y soluble en solventes orgánicos. En las células hay moléculas que cumplen estos requisitos y que se denominan lípidos biológicos. Incluyen a una gran variedad de lípidos tales como ácidos grasos, ceras, monoglicéridos, diglicéridos, triglicéridos, fosfolípidos, esfingolípidos, esteroles, terpenos, prenoles, eicosanoides, vitaminas solubles en grasas, entre otros.
En las células los lípidos tienen tres funciones básicas: ser componentes estructurales de las membranas biológicas, almacén de energía y actuar como moléculas señalizadoras, es decir, transportadoras de información. En esta página nos vamos a centrar sobre todo en los lípidos que están relacionados con las membranas biológicas.
La organización de las membranas celulares está determinada por las características de sus componentes, fundamentalmente por los lípidos. Los otros componentes importantes son las proteínas, principales actores en las funciones celulares asociadas a las membranas, y los glúcidos. Sin embargo, la diversidad de los lípidos de membrana (hay más de mil tipos diferentes) y su organización espacial (formando un bicapa) hacen a estas moléculas esenciales en la organización y función de las membranas. Los lípidos constituyen aproximadamente el 50 % del peso de las membranas, con unos 5 millones de moléculas por µm2. Se estima que aproximadamente el 5 % de los genes de una célula están relacionados con el metabolismo de sus lípidos.
Los lípidos definen las propiedades físicas de las membranas. La longitud y el grado de saturación de sus ácidos grasos regulan la fluidez y el grosor de la membrana. Hay una distribución desigual de tipos de lípidos entre las dos hemicapas creando lo que se denomina asimetría de membrana. Pero además, en la membrana plasmática las cargas asociadas a las partes hidrofílicas de los lípidos de la hemicapa interna contribuyen a crear un gradiente eléctrico entre la cara externa y la interna, y por tanto a modular el potencial eléctrico. Mediante interacciones electroquímicas, los lípidos son capaces de modular la actividad de las proteínas de membrana y de segregarse lateralmente, en el plano de la membrana, creando dominios funcionales (como las balsas de lípidos) que hacen a una misma membrana heterogénea y multifuncional. Por ejemplo, hacen que se asocien a una determinada región de la membrana unas proteínas u otras. Algunos lípidos funcionan como moléculas de señalización, abandonando las membranas y difundiendo por el citosol como segundo mensajeros para disparar resuestas celulares. Las diferentes membranas de la células tienen diferente composición de lípidos, lo que es importante para definir las propiedades de tales compartimentos y para establecer la identidad de éstos.
1. Tipos
En las células eucariotas se ha encontrado una diversidad enorme en los lípidos de membrana. Sin embargo, atendiendo a su estructura molecular, se pueden clasificar en tres grandes familias: los glicerolípidos, los esfingolípidos y los esteroles.
Glicerofosfolípidos
Los glicerofosfolípidos son los lípidos más abundantes ya que represetnan más del 70 % de los lípidos de las membranas celulares. Se les llama glicerofosfolípidos por poseer el grupo fosfato unido a una molécula de glicerol y tienen un papel relevante en la formación de la estructura bilaminar de la membrana y en las propiedades físicas de ésta. Molecularmente se caracterizan por poseer 2 cadenas de ácidos grasos unidos a una molécula de glicerol, y éste a un grupo fosfato (Figura 1). Las dos cadenas de ácidos grasos tienen de 13 a 19 átomos de carbono de longitud. Los ácidos grasos constituyen la parte hidrofóbica (fobia por el agua) de los glicerofosfolípidos y son los que constituyen la parte interna de las membranas. Una de las cadenas de ácidos grasos suele estar saturada (sin dobles enlaces entre los átomos de carbono) y unida al carbono 1 del glicerol y la otra es insaturada (con al menos un doble enlace entre los átomos de carbono) y unida al carbono 2. Los dobles enlaces entre los átomos de carbono de los ácidos grasos insaturados hacen que la cadena de ácido graso se doble y, aunque restrinja las posibilidades de movimiento espacial de la cadena, un aumento de la proporción de estos dobles enlaces aumenta la fluidez de la membrana puesto que provoca más separación entre moléculas. Al carbono libre del glicerol se le une un grupo fosfato, y al grupo fosfato se le pueden unir una variedad de grupos polares, tales como la colina, etanolamina, serina, inositol, etcétera.
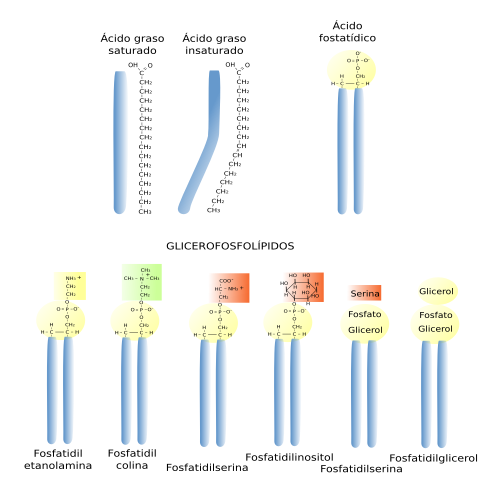
Los principales tipos de glicerofosfolípidos son: ácido fosfatídico (PA), fosfatidil colina (PC), fosfatidil etanolamina (PE), fosfatidil serina (PS), fosfatidil glicerol (PG), fosfatidil inositol (PI), cardiolipina (CL), presente en la mitocondrias, y el ácido lisofosfatídico (BMP/LSB), abundante en lisosomas, endosomas tardíos y multivesiculares.
Los glicosilfosfatidilinositoles (GPI) son fosfolípidos glicosidados, o glicolípidos. Los GPI son ubicuos en las células eucariotas y se unen covalentemente a proteínas por su extremos carboxilo, sirviento de puntos de anclaje para muchas proteínas de membrana. Los GPI también pueden encontrarse como lípidos libres. En sus cabezas polares contienen fosfatidil inositol, glucosamina, tres manosas, y etanolamina fosfato. La proteína se une a la etanolamina fosfato por un enlace amida.
Los glicerofosfolípidos también forman parte de las lipoproteínas del suero y actúan como surfactante en los conductos de los pulmones. Por otra parte, las células pueden almacenar grandes cantidades de lípidos similares a los glicerofosfolípidos denominados glicerolípidos, los cuales carecen del grupo fosfato y la cabeza hidrofílica. Se almacenan en el interior celular en forma de gotas de lípidos. Estos glicerolípidos, denominados neutros, son principalmente los triacilgliceroles, donde los tres carbonos del glicerol están unidos a cadenas de ácidos grasos. Por último, hay algunos glicerolípidos que tienen monosacáridos unidos al glicerol, son los gliceroglicolípidos, los cuales son muy escasos en los animales pero más frecuentes en las plantas y bacterias.
Esfingolípidos
Los esfingolípidos deben su nombre a que poseen una molécula de esfingosina, un alcohol nitrogenado con una cadena carbonada larga, a la cual se le une una cadena de ácido graso, formando la estructura básica denominada ceramida (Figura 2. Ver también See also ↗ ). La ceramida es biológicamente activa en las células y se encuentra como tal en las membranas celulares, pero en pequeña concentración. Aunque se hable de ceramida como una sola molécula, en realidad es un grupo de moléculas que difieren en la longitud de sus cadenas de ácidos grasos. A esta estructura de ceramida se añaden otras moléculas como azúcares o grupos fosfato que dan lugar a los diferentes esfingolípidos. Si se une a la ceramida un grupo fosfato más una colina o etanolamina tenemos al esfingomielina (serían fosfolípidos). Si se unen sacáridos tenemos a los glicoesfingolípidos. Los glicoesfingolípidos se pueden dividir en dos grandes grupos: glucoesfingolípidos y galactoesfingolípidos. Los primeros tienen una glucosa como primer glúcido, mientras que los segundos tienen una galactosa. Los galactoesfingolípidos abundan en la mielina del tejido nervioso y también se expresan en intestino, testículos y riñón. La configuración con un solo monosacárido da lugar a los glicoesfingolípidos denominados cerebrósidos.
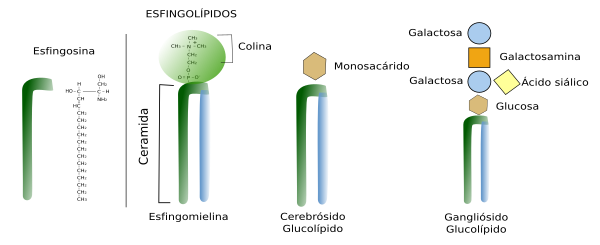
Si se añade a la glucosa una cadena de azúcares de al menos tres monosacáridos, siendo uno de ellos el ácido siálico, tenemos a los esfingolípidos denominados, gangliósidos. La diversidad de glicoesfingolípidos es enorme y difieren tanto en la composición de glúcidos como en su orden, pero también en la longitud de ácidos grasos que heredaron de la ceramida. En las células animales la gran mayoría de los glicolípidos son glicoesfingolípidos.
Estéroles
Los esteroles son el tercer grupo de lípidos más importante en las membranas biológicas. Su estructura química posee tres características: un grupo hidroxilo o alcohol en el carbono 3, cuatro anillos carbonados de los esteroides, y una cadena alifática (Figura 3). El colesterol es el esterol más importante de las células animales y el tercer tipo de lípido más abundante en la membrana plasmática (del 10 al 40 % del total de lípidos). Hay algunas membranas plasmáticas con una alta concentración de colesterol, como las de los eritrocitos o las que forman la mielina, que pueden llegar al 50 %, y a más del 50 % pueden llegar en las de las células fibrosas de las lentes del ojo. Sin embargo, aparece en proporciones proporciones en las membranas de los orgánulos celulares como en las del retículo endoplasmático (1-5 %), o en las membranas del aparato de Golgi (10 %).
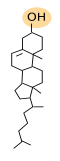
El colesterol no aparece en las membranas celulares de las plantas, en algunas células eucariotas, ni en las bacterias. Pero estas células tienen otro tipo de esteroles. En plantas es el fitoesterol el esterol más abundante y en los hongos se encuentra el ergosterol. En las gotas de lípidos de las células animales se suelen acumular una gran cantidad de ésteres de colesterol como sustancias de reserva.
El colesterol se integra bien entre los fosfolípidos con su cabeza polar hacia las cabezas polares de los fosfolípidos y el resto de la molécula entre los ácidos grasos. El colesterol, y los esteroles de membrana en general, son esenciales para la integridad y funcionamiento de las membranas eucariotas puesto que contribuyen a modular de la rigidez, la fluidez y la permeabilidad de las membranas, sobre todo la membrana plasmática. También participan en ciertos procesos metabólicos vitales como la síntesis de hormonas esteroideas o de sales biliares, entre otras. El colesterol contribuye también a modular la actividad de los receptores acoplados a proteínas G, facilita la transducción de señales y el tráfico vesicular. Junto con los esfingolípidos parecen contribuir a formar heterogeneidades laterales (balsas de lípidos), sobre todo en las membranas plasmáticas.
2. Distribución en membranas
Las diferentes membranas de las células eucariotas tienen una composición lipídica característica y en ocasiones muy diferente entre sí (Figuras 4 y 5). De este modo la propia identidad de un orgánulo viene determinada no sólo por las proteínas que posee sino por el juego de lípidos que compone sus membranas. Por ejemplo, la membrana plasmática tiene una composición lipídica diferente a la membrana del retículo endoplasmático o a la del aparato de Golgi. Mantener estas identidades no es fácil puesto que hay que contrarrestar el continuo intercambio de lípidos entre las distintias membranas mediado por vesículas y transportadores (Figura 5).
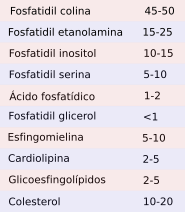
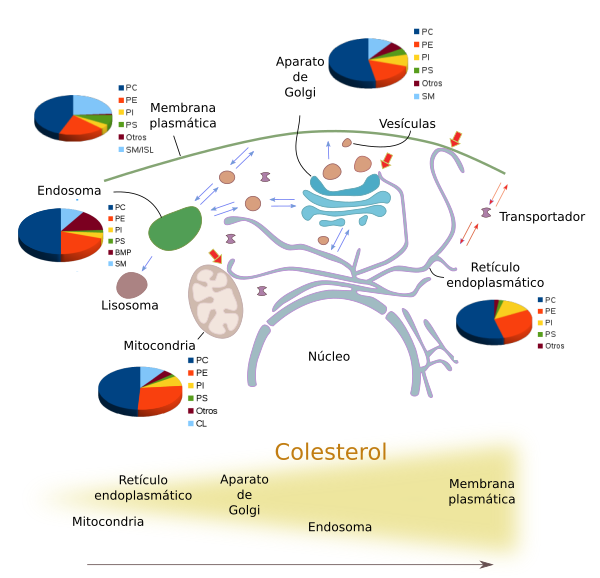
Aunque haya tipos de lípidos similares en las diferentes membranas, hay algunas diferencias importantes en las proporciones de éstos en cada membrana (Figura 5). Veamos una serie de ejemplos de esta distribución desigual. Todas la membranas tienen una gran proporción de fosfatidil colina, pero este glicerofosfolípido es más abundante en las membranas del retículo endoplasmático y en la membrana interna de las mitocondrias. Las cadenas de ácidos grasos de los lípidos son en general más saturadas en la membrana plasmática, lo que contribuye a la disminución de su fluidez y permeabilidad. En las membranas post-Golgi, es decir, membrana plasmática y endosomas, la concentración de esfingolípidos y colesterol es mayor que en el retículo y en las membranas del aparato de Golgi. El fosfoinosítido PI(4)P abunda en el aparato de Golgi y se ha usado tradicionalmente para identificar éste orgánulo. Las mitocondrias, aparte de otros lípidos más comunes de membrana, tienen cardiolipina, que sintetizan ellas mismas. Es interesante que en los procesos de maduración de algunos compartimentos, como es el caso de los endosomas, se cambia progresivamente la composición de algunos de sus lípidos. El ácido lisofosfatídico es abundante en las vesículas internas de los cuerpos multivesiculares y endosomas tardíos, representando hasta el 15 % del total de lípidos. Por otra parte el colesterol es más abundante a medida que nos desplazamos desde el retículo endoplasmático, al aparato de Golgi, endosomas tempranos y a la membrana plasmática.
También hay variaciones laterales en la proporción de tipos de lípidos que hacen que una misma membrana tenga distintos dominios funcionales. Hay interacciones de lípidos con proteínas y de lípidos con lípidos que crean asociaciones estables que se mueven por la membrana lateralmente. Las que se forman por interacciones de esfingolípidos con colesterol se denominan balsas de lípidos, y se cree que son plataformas de señalización que incorporan de manera preferente determinado tipo de proteínas. Los fosfolípidos con cadenas largas e insaturadas conviven en estas balsas de lípidos con los esfingolípidos y el colesterol. Otro ejemplo son los fosfolípidos como PI(3,4,5)P3, que se acumulan en la zonas de fagocitosis y en el frente de avance de las células que se mueven, y están ausenten de la parte apical de las células epiteliales. Estas heterogeneidades pueden depender también de procesos de síntesis y degradación locales.
Síntesis diferencial
La concentración de determinadas especies de lípidos en algunas membranas viene condicionada por su lugar de síntesis y su posterior reparto. El principal centro donde se sintetizan los lípidos es el retículo endoplasmático. En él se sintetizan los glicerofosfolípidos como la fosfatidil colina, y es aquí donde más abunda. En el retículo endoplasmático también se sintetiza la ceramida, base para los esfingolípidos. Pero éstos se terminan de ensamblar en el aparato de Golgi y son los compartimentos post-Golgi (membrana plasmática y endosomas) donde más abundan, estando por tanto ausentes en el retículo endoplasmático. Aunque no siempre ocurre así. Por ejemplo, el colesterol se sintetiza también en el retículo endoplasmático, pero es más abundante en membranas post-Golgi (membrana plasmática y endosomas temprano). Esto es debido a que es transportado rápidamente a otras membranas.
La síntesis de lípidos no necesariamente significa ensamblaje desde cero, sino que se pueden sintetizar lípidos a partir modificaciones de otros preexistentes mediante enzimas capaces de degradar parcialmente dicho lípido y otras que sintetizan partes de la molécula. Estos enzimas se distribuyen de manera diferencial por los distintos compartimentos membranosos. Durante los procesos de síntesis de unos lípidos se emplean a otros como donantes de partes moleculares por lo que a la vez que se sintetiza una nueva especie lipídica desaparece otra, y todo contribuye a cambiar la composición lipídica de la membrana de ese compartimento. Por ejemplo, la maduración de algunos orgánulos como los endosomas supone una variación progresiva en el tipo de lípidos de sus membranas, la cual ocurre en parte debida al metabolismo y modificación de unas especies de lípidos para convertirse en otras.
Selección y transporte
A pesar de la gran cantidad de lípidos que se pueden transportar en una vesícula, el intercambio de lípidos entre membranas no parece depender mayoritariamente del tráfico vesicular, o al menos no es imprescindible. De hecho, aunque se inhiba el transporte vesicular, se siguen transportando lípidos entre compartimentos. Actualmente se piensa que el trasiego de lípidos entre membranas está basado sobre todo en transportadores de lípidos, que son proteínas capaces de extraer un lípido de una membrana, transportarlo por el citosol y colocarlo en otra membrana o crear canales para que los lípidos difundan de una membrana a la otra. Los intercambiadores también pueden ser homotípicos, transportan siempre el mismo lípido, o heterotípicos, cuando son capaces de transportar más de un tipo de lípido. Se cree que este intercambio de lípidos entre membranas no mediado por vesículas ocurre fundamentalmente en los sitios de contactos entre membranasr.
Las vesículas transportan lípidos en grandes cantidades, ya que forman sus membranas con los lípidos de las propias membranas del compartimento de partida. Este transporte puede tener un cierto grado de selectividad. Por ejemplo, las vesículas que van desde el Golgi a la membrana y a los endosomas están enriquecidas en esfingolípidos y colesterol, respecto la concentración de estas moléculas en las propias membranas del Golgi.
Los intercambios de lípidos mediados por proteínas se cree que operan sobre todo en los sitios de contactos entre membranas. Las membranas de determinados orgánulos pueden observarse extremadamente próximas en imágenes de microscopía. Estos lugares son puntos calientes de comunicación entre membranas donde se puede producir intercambio de lípidos. Hay proteínas que se colocan entre las membranas de dos orgánulos cuando están muy próximas espacialmente, haciendo de puente para el trasiego de lípidos entre las membranas de ambos orgánulos. Hay dos familias de transportadores: aquellos que sacan un lípido de una membrana, lo protegen del entorno acuoso del citosol y lo insertan en la otra membrana, y aquellos que crean pasadizos hidrófobos a través de los cuales los lípidos pueden difundir entre membranas (Figura 7).
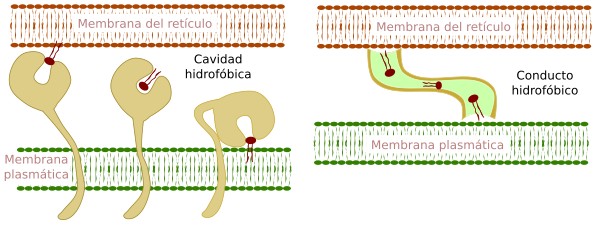
Estos intercambios ocurren entre membranas de compartimentos que no están comunicados mediante vesículas, por ejemplo, entre el retículo endoplasmático y las mitocondrias. Pero también entre compartimentos comunicados por vesículas como el retículo endoplasmático y el lado trans del aparato de Golgi, entre el retículo endoplasmático y los endosomas, o entre el retículo endoplasmático y la membrana plasmática (Figura 8).
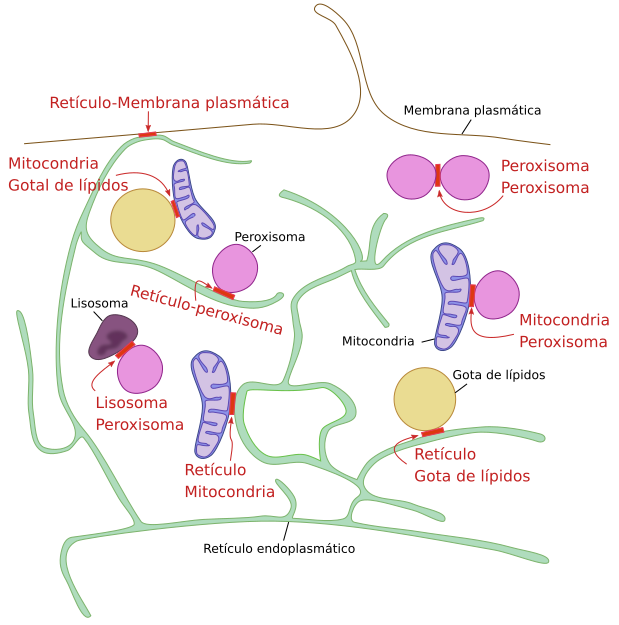
Hay numerosos ejemplos de este intercambio de lípidos en los sitios de contacto entre membranas. Por ejemplo, el complejo proteico CERT ("ceramide transfer protein"c) transfiere ceramida desde las membranas del retículo endoplasmático al lado trans del aparato de Golgi. Este tipo de transporte es importante también para trasladar lípidos desde el retículo a otros orgánulos que no están conectados por vesículas, como es el caso de las mitocondrias. El colesterol es un lípido que se intercambia con mucha frecuencia en los contactos entre membranas, y parte de la alta concentración de colesterol existente en la membrana plasmática se debe a estas interacciones, donde su transporte está acoplado al co-transporte de otros lípidos. El colesterol sintetizado en las membranas del retículo endoplasmático se transfiere a las membranas del dominio trans del aparato de Golgi mediante contactos físicos. El colesterol pasa del retículo al dominio trans gracias a un intercambiador llamado OSBP (“oxysterol binding protein”), a cambio de un fosfoinosítido PI(4)P, el cual es más abundante en las membranas del dominio trans que en las del retículo. El gradiente de PI(4)P se utiliza para el transportar colesterol, que viaja en contra de gradiente. El PI(4)P es rápidamente transformado en PI en el retículo, lo que sirve para regenerar el gradiente de PI(4)P. Una vez en el dominio trans, el colesterol se asocia con los esfingolípidos y forma una zonas de mayor densidad lipídica, que son lugares donde se forman vesículas que viajan desde el aparato de Golgi hasta la membrana plasmática.
Para el colesterol de origen externo, los contactos entre los lisosomas y los peroxisomas son muy importantes. El colesterol de la dieta llega a los lisosomas por endocitosis y sale de los lisosomas hacia los peroxisomas por zonas de contacto entre membranas. En los peroxisomas el colesterol formará parte de ciertas rutas metabólicas, como las síntesis de sales biliares.
¿Cómo es posible mantener la diferencia de lípidos entre compartimentos? Se han propuesto varios mecanismos. Una vez que los lípidos llegan al compartimento diana quedan atrapados por modificación química, asociación con otras moléculas, o secuestro termodinámico. La ceramida, por ejemplo, una vez transportada al Golgi es transformada en esfingomielina o esfinglicolípidos (modificación química). El colesterol queda atrapado entre las moléculas de ácidos grasos saturados, que abundan en las membranas post-Golgi (asociación entre moléculas). También pueden quedar atrapadas por interacciones eléctricas, como la fosfatidil serina en la cara citosólica de la membrana plasmática (secuestro termodinámico).
3. Asimetría. Distribución entre hemicapas
La distribución asimétrica de los lípidos en las membranas significa que la composición lipídica de la hemicapa citosólica es diferente a la luminal (interior del orgánulo) o extracelular (Figura 9). Esta diferente distribución de lípidos entre hemicapas se produce principalmente en el aparato de Golgi y en otros compartimentos celulares, y menos en el retículo endoplasmático, donde hay una distribución más parecida entre las dos hemicapas de sus membranas. Para los lípidos con cabeza polar grande es difícil cruzar de una hemicapa a la otra (movimiento del tipo “flip-flop”) por la barrera que supone el ambiente hidrófobo que generan las cadenas de ácidos grasos. Sin embargo, para otros lípidos con zona polar poco voluminosa, como el colesterol, diacilglicerol, ceramida o ácidos grasos protonados, el cambio entre hemicapas es más frecuente. Los glicerofosfolípidos de cabezas polares grandes pueden salvar la barrera hidrófoba de los ácidos grasos mediante unos transportadores específicos localizados en las membranas. Hay tres tipos: flipasas, flopasas y mezcladoras ("scramblases") (Figura 10). Estas proteínas dependientes de energía se encargan de transportar glicerofosfolípidos entre las dos hemicapas y generar asimetría. Las flipasas transportan lípidos hacia la hemicapa citosólica, las flopasas hacia la hemicapa luminal (o extracelular) y las mezcladoras en ambas direcciones. Hay que tener en cuenta que son familias de proteínas y que dentro de cada una hay subtipos con apetencias por lípidos diferentes. Una vez generada, esta desigual distribución de los lípidos entre hemicapas se mantiene por la propia dificultad de los movimientos “flip-flop”. Los esfingolípidos, sin embargo, no son intercambiados por estas enzimas y permanecen en la hemicapa donde se sintetizan, es decir, en la luminal del aparato de Golgi, que será posteriormente la externa de la membrana plasmática. Más del 80 % de los esfingolípidos de la membrana plasmática se localizan en la hemicapa externa.
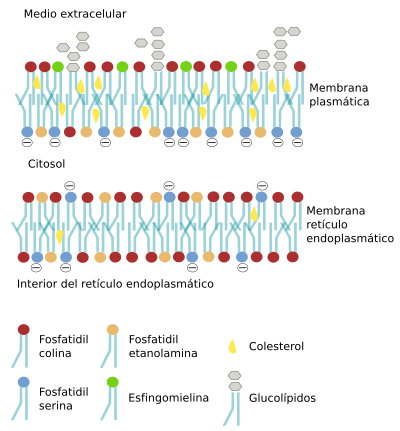
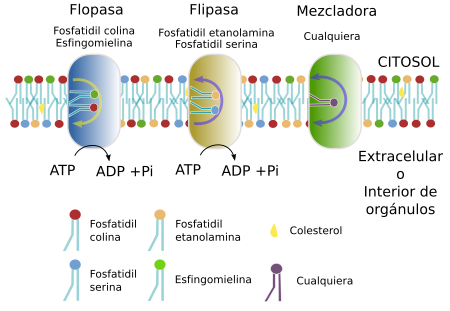
En la membrana plasmática, la hemicapa orientada hacia el exterior contiene una mayoría de los lípidos que poseen colina, como la fosfatidil colina y la esfingomielina, mientras que la fosfatidil etanolamina, fosfatidil inositol y la fosfatidil serina se localizan principalmente en la hemicapa citosólica. El diacilglicerol puede hacer flip-flop fácilmente, pero no el resto de los fosfolípidos. Algunos lípidos como el ácido lisofosfatídico hacen flip-flop con más facilidad cuando el ambiente es ácido, cosa que puede ser interesante en los endosomas tardíos y lisosomas. Aunque se ha dicho tradicionalmente que las membranas del retículo son simétricas existe cierta asimetría. Por ejemplo la fosfatidil serina se concentra en su cara luminal.
Sin embargo, parece que la asimetría no es tan estricta como se suele pensar cuando se comparan tipos celulares. Por ejemplo, la proporción de fosfatidil colina en la hemicapa externa no es igual en todas las células de un organismo, ni siquiera entre los eritrocitos de diferentes especies. En los eritrocitos humanos del 76 al 78 % de la fosfatidil colina de la membrana se localiza en la hemicapa externa, mientras que en ratones es el 50 %.
4. Distribución lateral
Hemos visto que los lípidos se distribuyen desigualmente entre membranas diferentes y también entre las dos hemicapas de una misma membrana. Hay evidencias de que en la misma hemicapa de una membrana también hay una distribución heterogénea de lípidos, es lo que se llama heterogeneidad lateral. Esta distribución irregular crea zonas con una composición lipídica particular que se suelen considerar como dominios de membrana.
Los dominios de membrana se crearían por interacciones fisicoquímicas entre lípidos, entre lípidos y proteínas, y por el proceso de reciclado de la membrana. Parece haber diferentes tipos de dominios según su estabilidad, tamaño y tipos de lípidos que mayoritariamente están presentes. Estos dominios parecen ser muy dinámicos: pueden variar en tamaño, desde decenas hasta cientos de nanómetros, fusionarse entre sí o dividirse, y pueden mantenerse desde segundos a minutos.
La ventaja funcional de estos dominios es que son espacios con unas condiciones físico-químicas particulares donde se facilitarían determinados procesos moleculares. Para ello algunas proteínas se sentirían más cómodas en estos dominios que fuera de ellos y llevarían a cabo su actividad con una mayor probabilidad. Además, ciertos mecanismos que impliquen a dos moléculas se acelerarían si dichas moléculas estuvieran próximas por su apetencia, es decir, mayor probabilidad de encontrarse en estos dominios. Por último, hay datos que sugieren que ciertos virus utilizan a estos dominios para entrar en las células puesto que las fases de reconocimiento y anclaje se ven favorecidas en estos ambientes químicos.
Se han descrito varios tipos de dominios laterales (Figura 11). Uno de ellos son las denominadas balsas de lípidos. Estos dominios se propusieron en 1997. Son microdominios del orden de nanómetros, muy dinámicos: crecen y disminuyen su área, se crean y se destruyen con facilidad. Se formarían por la asociación entre el colesterol y los esfingolípidos. El colesterol se colocaría entre las cadenas de ácidos grasos y permitiría una disposición más compacta de los esfingolípidos, lo cual provocaría un área de mayor densidad de lípidos respecto al resto de la hemicapa, formada principalmente por fosfolípidos y que sería más fluida. Esta “balsa” se movería lateralmente y algunas proteínas tenderían a estar más tiempo dentro de la balsa que fuera, con lo que podrían viajar un tiempo dentro de este ambiente químico y su actividad se vería modificada.
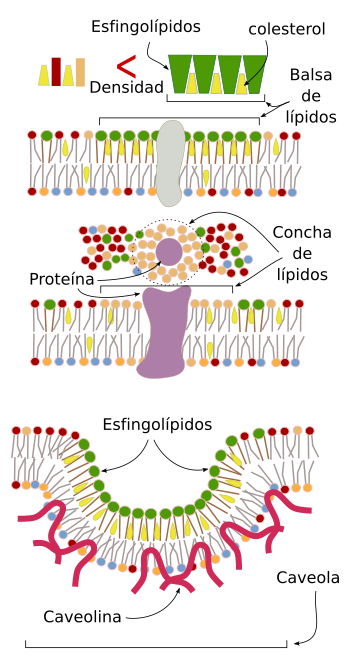
Las caveolas son otro tipo de dominio lateral. Son porciones de la membrana, fundamentalmente de la membrana plasmática, en las cuales abundan el colesterol, los esfingolípidos y unas proteínas denominadas caveolinas. Estas regiones se invaginan para formar, en muchos casos, vesículas de endocitosis, llevando consigo receptores y proteínas integrales de membrana, los cuales son atrapados en estas regiones gracias a la composición diferente de lípidos. Sin embargo, las caveolas parecen tener también otras funciones como controlar la composición molecular de la membrana o contrarrestar tensiones mecánicas.
Otro mecanismo para generar heterogeneidades laterales es la interacción de los lípidos con las proteínas trasnsmebrana. Ciertas proteínas transmembrana se desplazarían lateralmente por la membrana asociadas a un conjunto de lípidos, a los cuales atraerían por interacciones electroquímicas, de manera que estos lípidos formarían una periferia molecularmente diferente al resto de la membrana.
Aunque tradicionalmente se ha pensado que la hemicapa externa y la interna de la membrana son independientes a la hora de distribuir sus heterogeneidades lipídicas respectivas, hay evidencias que pueden influirse entre sí. Una manera es por la presencia de proteínas transmembrana que afectan simultáneamente a ambas hemicapas, pero también puede ocurrir sin la intervención de proteínas. Otra posibilidad de sincronización de heterogeneidades entre las dos hemicapas puede ser debida a la longitud de las cadenas de ácidos grasos como las de algunos esfingolípidos, las cuales puede ser de hasta 24 átomos de carbono (normalmente son 18), con lo que se insertarían entre los ácidos grasos de los lípidos de la otra hemicapa afectando a la distribución lipídica. También se podrían sincronizar hemicapas mediante agrupaciones de lípidos de cadena larga en una hemicapa, en la otra suele haber otros de cadena corta para homogeneizar el espesor de la membrana.
5. Síntesis
Existen multitud de enzimas para la síntesis de los diferentes tipos de lípidos localizadas principalmente en el citosol, en las membranas del retículo endoplasmático, del aparato de Golgi, y, en el caso del colesterol, en otros orgánulos. Hay que destacar que los lípidos son difícilmente liberados por la célula, al contrario que otras moléculas hidrosolubles. Por tanto, además de para la síntesis, la célula debe disponer también de un arsenal enzimático para catabolizar los lípidos que va sintetizando continuamente. La acumulación de cualquier especie de lípido de manera incontrolada implica toxicidad para la célula.
Los tres tipos de lípidos más abundantes de las membranas de las células, glicerolípidos, esfingolípidos y esteroles, empiezan su proceso de síntesis en el retículo endoplasmático.
Glicerofosfolípidos
Los glicerofosfolípidos se sintetizan en el retículo endoplasmático gracias a unas enzimas localizadas en sus membranas que tienen su centro activo orientado hacia la el citosol (Figura 12). Sin embargo, algunos glicerofosfolípidos terminan de sintetizarse en el aparto Golgi y la fosfatidil etanolamina se puede también sintetizar en las mitocondrias. El proceso comienza con la llegada de una cadena de ácido graso, transportada a través del citosol, que se inserta en la hemicapa externa de la membrana del retículo por una proteína denominada proteína de unión a ácidos grasos. Este ácido graso se activa mediante la adición de un coenzima-A. La unión de dos ácidos grasos activados a una molécula de glicerol 3-fosfato por una acil transferasa produce una molécula denominada ácido fosfatídico. El ácido fosfatídico pierde el grupo fosfato y se convierte en diacil glicerol. La fosfatidil colina, fosfatidil serina, y el fosfatidil inositol se sintetizan mediante la adición de CDP-colina, CDP-serina o CDP-inositol al diacil glicerol, respectivamente. La fosfatidil serina, en mamíferos, se sintetiza a partir de la CDP-colina o de la fosfatidil colina o fosfatidil etanolamina. Los enzimas responsables de este proceso están concentradas en las membranas del retículo endoplasmático, y son especialmente abundantes en las zonas de contacto entre membranas del retículo y de las mitocondrias.
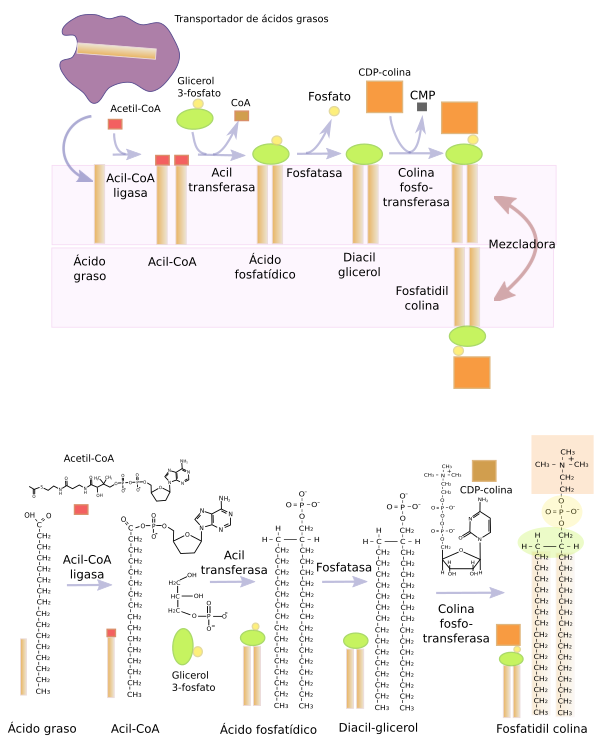
El ácido fosfatídico, que es la base para todos los glicerofosfolípidos al dar diacilglicerol, se sintetiza mayoritariamente en el retículo endoplasmático, y una pequeña proporción en la membrana externa de la mitocondria.
Los glicerofosfolípidos se pueden sintetizar también en prácticamente cualquier compartimento celular mediante modificación química de lípidos preexistentes. Así, la fosfatidil etanolamina sirve para producir la fosfatidil serina en el retículo endoplasmático. La fosfatidil serina, la fosfatidil colina, y fosfatidil etanolomina, pueden cambiar sus cabezas hidrofílicas por otras para convertirse en otro lípido. Por ejemplo, una fosfatidil colina puede cambiar la colina por una serina y se convierte en una fosfatidil serina. Otras modificaciones pueden ser cambios químicos de la cabeza hidrofílica. Así, la fosfatidil etanolamina también se puede formar desde la fosfatidil serina. De la misma manera se pueden perder las cabezas hidrofílicas y tener de nuevo diacil gliceroles. El ácido lisofosfatídico se sintetiza mayoritariamente en los cuerpos multivesiculares por modificaciones de otros lípidos. En algunas ocasiones esta transferencia se produce entre lípidos de diferente tipo. Así, la fosfatidil colina es donante de la fosfocolina para producir esfingomielinas en el aparato de Golgi.
Un ejemplo claro de conversión de unas especie de lípido en otro, con importantes cambios en sus funciones, es el del fosfatidil inositol. El fosfatidil inositol puede ser fosforilado en tres sitios de su cabeza polar para dar diferentes fosfolípidos que forman una familia de fosfoinosítidos con una dos y tres fosforilaciones, que además pueden tener combinaciones diferentes. Las fosfatasas y fosforilasas en cada compartimento celular controlan el tipo de fosfoinosítido que posee dicha membrana. El fosfatidil inositol no se sintetiza a partir del diacilglicerol sino de CDP-diacilglicerol.
Esfingolípidos
La base molecular sobre la que se construyen los esfingolípidos es la ceramida. Ésta se sintetiza en las membranas del retículo endoplasmático por una serie de pasos a de partir un aminoácido, principalmente la serina, y de acil-coenzima A, que da di-hidro-esfingosina. A ella se une un ácido graso para dar ceramida (Figura 13). Después de su formación, la ceramida es trasportada desde el retículo endoplasmático al aparato de Golgi para formar esfingolípidos más complejos. Este trasvase se realiza por dos mecanismos: en vesículas o mediante transportadores de ceramida (CERT). Sin embargo, en el caso de los galactoesfingolípidos, la enzima responsable de añadir la galactosa se encuentra en las membranas del retículo endoplasmático.
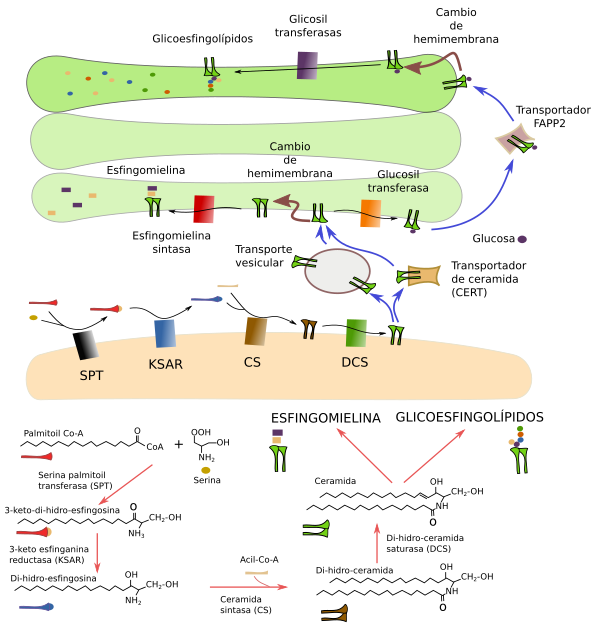
Una vez en el lado cis del aparato de Golgi la ceramida puede seguir dos rutas: síntesis de esfingomielina mediante la adición de un grupo fosfato más una colina, o síntesis the glucoesfingolípidos por la adición de una glucosa. Las esfingomielinas son las más abundantes de los esfingolípidos de membrana y son absolutamente imprescindibles para la viabilidad de los organismos y de sus células. La esfingomielina se genera por la trasferencia de un grupo fosfo colina desde un lípido fosfatidil colina a una ceramida, generándose un diacilglicerol y una esfingomielina. Los glucoesfingolípidos son trasladados al dominio trans del aparato de Golgi para convertirse en glicoesfingolípidos mediante la adición de más monosacáridos por enzimas que los transfieren (glicosil trasnferasas). Es destacable que los animales sin la capacidad de producir glucoesfingolípidos no son viables, pero sí los cultivos in vitro de sus células. El fosfatidill inositol PI(4)P es fundamental para la síntesis de esfingolípidos en el aparato de Golgi por interaccionar con proteínas que participan en su síntesis.
Colesterol
El colesterol que hay en las células puede tener dos orígenes: sintetizado por la propia célula o venir desde el exterior celular en los alimentos. La síntesis de colesterol por la célula es una larga ruta metabólica en la que participan numerosas enzimas citosólicas y localizadas en varios orgánulos, pero la mayoría de ellas están asociadas a las membranas del retículo endoplasmático. En el retículo se encuentran la hidroximetilglutaril reductasa y aquellas implicadas en los últimos pasos de la ruta metabólica antes de obtener el colesterol (Figura 14). El colesterol es rápidamente transportado a otras membranas de la célula tras su síntesis en las membranas del retículo. La síntesis de colesterol está regulada por su concentración, de modo que cuando es excesiva se eliminan las enzimas responsables de su síntesis. La principal enzima responsable de este mecanismo de detección es la hidroximetilglutaril reductasa. El exceso de colesterol en el retículo produce su esterificación y se almacena en las gotas de lípidos.
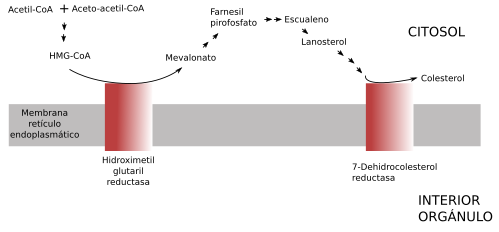
El colesterol de origen externo se incorpora de los alimentos. Tras la digestión, las moléculas asimiladas son transportadas al hígado por el sistema porta. En el hígado el colesterol es empaquetado en lipoproteínas de baja densidad (LDL) y se reparten por el resto del cuerpo, donde las células lo incorporan fundamentalmente por endocitosis mediada por receptor. Las vesículas de endocitosis se fusionan con los endosomas tempranos y estos maduran a endosomas tardíos que se fusionan con los lisosomas, donde las LDL son degradas. Aquí se acumula el colesterol y es repartido a otros compartimentos celulares. Se estima que el 80 % del colesterol de una célula animal se incorpora por endocitosis mediada por receptor.
Todos los tejidos animales pueden conseguir colesterol de estas dos fuentes, propio o externo, excepto el tejido nervioso que sólo tiene colesterol propio porque las LDL no pueden cruzar la barrera hematoencefálica.
5.1. Mitocondrias
En las mitocondrias se encuentran lípidos típicos de otras membranas de la célula. La composición de lípidos en las mitocondrias es importante sobre todo en la membrana interna para las proteínas que participan en la fosforilación oxidativa o respiración, principal centro de producción de ATP de la célula. En las membranas de las mitocondrias abundan la fosfatidil colina, la fosfatidil etanolamina, el fosfatidil inositol y la fosfatidil serina, que se encuentran también en otras membranas. Pero poseen lípidos exclusivos como el fosfatidil glicerol y la cardiolipina. Las mitocondrias poseen concentraciones muy bajas de esfingolípidos y colesterol.
La función que tiene el colesterol en la membrana plasmática, donde mantiene un equilibrio entre fluidez e hidrofobicidad (impermeabilidad), lo hace la cardiolipina en la membrana interna de la mitocondria. Aquí la hidrofobicidad es importante puesto que el gradiente de protones creado durante la fosforilación oxidativa ha de mantenerse haciendo a la membrana relativamente impermeable. Así es esencial para mantener la estructura y el potencial de la membrana mitocondrial interna, además de para crear un ambiente adecuado para las proteínas de la cadena respiratoria. Esto es importante puesto que en esta membrana la proporción de proteínas es muy alto respecto a la de lípidos. Por ejemplo, la ausencia de cardiolipina produce malformaciones o desestabiliza algunos complejos proteicos de la cadena respiratoria. La cardiolipina es además es necesaria para importar esas proteínas a la membrana (téngase en cuenta que algunas se sintetizan en el citosol).
Las mitocondrias se fusionan entre sí y se dividen. Esto requiere unir y separar membranas constantemente. La cardiolipina, el ácido fosfatídico y el fosfatidil etanolamina son necesarios para estos procesos.
La fosfatidil colina y la fosfatidil serina se sintetizan en el retículo endoplamático, y deben importarse a las mitocondrias. La fosfatidil etanolamina se puede obtener en la mitocondria a partir de la fosfatidil serina o importarse desde el retículo. La cardiolipina se sintetiza exclusivamente en la mitocondria. Independientemente del lugar de síntesis, los lípidos tienen que pasar de una membrana de la mitocondria a la otra, y esto parece favorecerse por los contactos directos entre ambas membranas. Los contactos entre membranas funcionan también para el trasiego de lípidos entre el retículo endoplasmático y las mitocondrias.
5.2. Cloroplatos
Este orgánulo es el principal centro de producción de cadenas de ácidos grasos de las células vegetales. Estos ácidos grasos se exportan al retículo endoplasmático, donde se utilizan para la síntesis de otros lípidos. Entre ellos está el diacil glicerol, que debe volver al cloroplasto donde se sintetizarán a partir de él los galactosil glicerolípidos. Al igual que ocurre con las mitocondrias, la comunicación entre el retículo y el cloroplasto es esencial para mantener la composición lipídica típica.
Los cloroplastos tienen una composición particular de lípidos, entre los que se encuentran los galactosil glicerolípidos, los cuales sólo se sintetizan y se encuentran en los cloroplastos. Los galactolípidos son esenciales para los cloroplastos, sobre todo para la membrana de los tilacoides donde mantienen las condiciones óptimas para el funcionamiento de la cadena fotosintética. Pueden representar entre el 25 y el 50 % de todos los lípidos de la membrana tilacoidal, y hasta el 60 % de los lípidos de las membranas interna y externa del cloroplasto. El único fosfolípido sintetizado en el cloroplasto, el fosfatidil glicerol, es crítico para el funcionamiento fotosistema II de la cadena de transporte de electrones. La composición lipídica de las cianobacterias es similar a la de los cloroplastos, y esto tiene sentido puesto que ambos comparten un ancestro común.
6. Funciones
Estructura de la membrana
La naturaleza química de los lípidos hace que se organicen espontáneamente en bicapas lipídicas, como las de las de las membranas de las células. La fosfatidil colina es la principal responsable de esta propiedad, siendo además el lípido más abundante de los animales (¡excepto en Drosophila!). Las otras especies de lípidos también tienen la capacidad de formar bicapas. La composición de glicerofosfolípidos, esfingolípidos y colesterol de una membrana, tanto en la diversidad de sus cabezas como en la longitud de sus ácidos grasos, afecta a la fluidez, grosor, curvatura y carga eléctrica de dicha membrana. Pero también modifican la actividad de las proteínas de membrana y sirven para anclar y asociar a las membranas a otras moléculas como las proteínas.
La fosfatidil colina forma en torno al 50 % de los lípidos de las membranas eucariotas y suele poseer una cadena saturada y otra con un enlace insaturado. Su conformación espacial cilíndrica les hace ideales como principales determinantes de lafluidez, componentes estructurales de las membranas. Pero los lípidos de membrana, además de su función estructural, afectan a otros aspectos de la membrana. Así, los esfingolípidos, al contrario que las fosfatidil colina, suelen tener sus cadenas saturadas y más largas, generando áreas de membrana más compactas y más gruesas. El colesterol, por otra parte, tiene diferentes efectos dependiendo de la membrana donde se encuentre: impide que las cadenas de ácidos grasos se empaqueten demasiado, es decir, se impide el estado de gel sólido más rígido, pero en las membranas más fluidas aporta una mayor rigidez por reducir al flexibilidad de las cadenas insaturadas. La mayor concentración de colesterol, de esfingolípidos y una mayor saturación de las cadenas de ácidos grados hace a la membrana plasmática, más rígida, más ancha, y por tanto más impermeable, que las membranas internas de la célula.
Hay otros glicerolípidos cuya estructura molecular adopta un volumen en forma cono. Es el caso del ácido fosfatídico, aunque es poco abundante en las membranas (1 a 2 %). La fosfatidil etanolamina es un componente básicamente estructural, al igual que fosfatidil colina, y también tiene una forma cónica. Esta conformación espacial podría facilitar procesos de curvatura y fusión de membranas. Cualquier curvatura de la membrana crea una hemicapa cóncava y otra convexa. Aquellos lípidos cónicos, es decir, aquellos que tienen una cabeza pequeña comparada con el volumen que ocupan sus ácidos grasos, inducen o favorecen curvaturas convexas, mientras que aquellos con cabezas grandes favorecen curvaturas cóncavas. Esta regla se cumple en membranas artificiales, pero la curvatura de las membranas en la célula viene determinada por la acción de las proteíans, aunque la presencia de estos lípidos puede ayudar a estabilizar tales curvaturas. La proporción entre lípidos cilíndricos y cónicos está bien regulada en la célula.
La presencia de determinados lípidos en una membrana, su localización en una de las hemicapas o su concentración en un dominio lateral condiciona la asociación a la membrana de ciertas proteínas, lo que determina la funcionalidad de la propia membrana. Así, el glicosil-fosfoinositol, derivado del fosfoinositol, sirve para anclar proteínas de forma permanente a la membrana plasmática, normalmente a la hemicapa extracelular.
La distribución de los glicerofosfolípidos con carga eléctrica negativa (lípidos aniónicos) en sus cabezas polares se concentra en la cara citosólica de la membrana plasmática. De este modo esta superficie de la membrana tiene una carga eléctrica neta, lo que permite dos funciones: contribuir al potencial eléctrico de la membrana y crear un ambiente iónico adecuado para la asociación y para la actividad adecuada de ciertas proteínas citosólicas. Algunos lípidos como el fosfatidil inositol y la fosfatidil serina son aniónicos, es decir, tienen carga neta negativa, y algunos esfingolípidos son catiónicos, aunque la mayoría de los lípidos no tienen carga neta. La asimetría de membrana crea esta distribución diferente de cargas entre ambas hemicapas de la membrana. Se ha comprobado que en ausencia de iones en el medio la membrana plasmática es capaz de producir un potencial de membrana por sí misma debido a la mayor concentración de cargas negativas en la hemicapa interna. Esta carga aniónica local también afecta a las proteínas transmembrana puesto que sus dominios citosólicos son sensibles a los ambientes eléctricos, y de esta manera se modula su actividad. Por ejemplo, en el caso de los canales iónicos se aumenta o disminuye la probabilidad de cierre o apertura dependiendo del potencial de membrana. Además, facilita la asociación específica de proteínas a la membrana cuando éstas necesitan un ambiente eléctrico determinado. Hay proteínas como K-Ras, Src, o Rac1, que son policatiónicas y por tanto serán atraídas por lugares de la membrana donde abunden los lípidos aniónicos. Los fosfo inosítidos bi- y tri-fosforilados contribuyen de manera importante a la carga aniónica de la membrana donde se encuentran. A esta carga citosólico depende del tipo de membrana. Por ejemplo, la cara citosólica de el retículo endoplasmático presenta una carga neta neutra ideal para reacciones bioquímicas.
Para ver el efecto de los lípidos en la modificación de la permeabilidad y fluidez de la membrana ver esta página: ↗
Señalización
Los lípidos afectan a la comunicación celular y participan en ella. Esto puede ser bien porque crean ambientes o plataformas donde las cascadas de señalización se vean favorecidas o por que son ellos mismos las propias señales. En el primer caso tenemos como ejemplo a las balsas de lípidos, asociaciones principalmente de esfingolípidos y colesterol, que crean ambientes diferentes en la membrana en los que algunos receptores son capaces de realizar mejor sus mecanismos de transducción tras unirse al ligando. También se aumenta la probabilidad de interacción de proteínas implicadas en una cascada de señalización al favorecer su proximidad física.
Hay otros tipo de señalización en los que intervienen directamente los lípidos. Así, la rotura de la asimetría lipídica en la membrana plasmática funciona como una señal de que hay alteraciones en la célula. Por ejemplo, las células que sufren apoptosis, muerte celular programada, exponen rápidamente la fosfatidil serina en la hemicapa externa y esto es una señal de "cómeme" para que los macrófagos eliminen esa célula. También es importante para el inicio de la coagulación sanguínea. Incluso algunos virus con membrana exponen en su hemicapa externa fosfatidil serina y fostatidil etanolamina para ser incorporados a las células con más facilidad por macropinocitosis o fagocitosis.
Hay más ejemplos. El lípido fosfatidil inositol PI(4,5)P2, localizado en la hemicapa interna, al ser degradado por ciertas fosfolipasas se divide en dos moléculas, una de las cuales, IP3, viaja por el citosol y actúa como segundo mensajero, afectando a la liberación de calcio desde el retículo endoplasmático. La fosfatidil colina es una fuente de ácido araquidónico, el cual se transforma en prostaglandinas.
Formación de vesículas / tráfico vesicular
Los lípidos son relevantes en la ruta vesicular. En los procesos de endocitosis mejor estudiados (endocitosis dependiente de clatrina, fagocitosis y macropinocitosis) los lípidos participan como elementos activos.
La endocitosis mediada por clatrina necesita PI(4,5)P2 durante las fases de nucleación, selección de cargas y ensamblaje de la cubierta, pero debe desaparecer de la zona durante la escisión y eliminación posterior de la cubierta. La endocitosis mediada por clatrina se inicia en zonas ricas en PI(4,5)P2, los cuales reclutan las moléculas necesarias para iniciar la nucleación, entre las que se encuentran GTPasas y moléculas tipo BAR que deforman la membrana, tales como al anfifisina y endofilina. Pero también otras proteína relacionadas con la formación de la vesícula son capaces de unirse a este fosfolípido, tales como la dinamina y las propias proteínas adaptadoras AP-2, las cuales se unen a la vez a la carga y a la cubierta de clatrina. Sin embargo, los procesos de escisión y eliminación de la cubierta de la vesícula una vez liberada la vesícula requieren una disminución drástica de la concentración de PI(4,5)P2 en las membranas. Esto se lleva a cabo por fosfatasas. Estas fosfatasas se reclutan durante la formación de la vesícula. Es obvio por qué esto es necesario puesto que si esta molécula produce una atracción de moléculas para formar la vesícula, es necesaria su eliminación para que se pierda la afinidad de las moléculas de la cubierta por la membranas. Es interesante que la eliminación de el PI(4,5)P2 de las membranas ya curvadas ayuda en el proceso de escisión.
La fosfatidil etanolamina es importante durante la formación del autofagosoma puesto que permite la unión moléculas adaptadoras solubles. También interactúa con proteínas de la membrana produciendo modificación de su actividad. PI(4,5)P2 también participa en la fagocitosis mediante su asociación con la actina y probablemente favorezca su polimerización, pero tiene que ser eliminado en la última fase la formación del fagosoma. PI(4,5)P2 es convertido o degradado en varias moléculas, entre ellas PI(3,4,5)P3, que se acumula en el fagosoma naciente donde prodía reclutar la proteína motora miosina. La maduración del fagosoma es similar a la de los endosomas, pero en los fagosomas también se tienen que reclutar proteínas que acaben con los patógenos ingeridos, como aquellas que generen sustancias reactivas del oxígeno par que produzcan oxidación. PI(3)P es importante para el reclutamiento de estas enzimas.
PI(4)P es muy abundante en el aparato de Golgi, y además de colaborar en la síntesis de esfingolípidos, es capaz de captar la proteínas adaptadoras AP-1 al lado trans. Esto regula el tráfico vesicular anterógrado.
PI(3)P está asociado con la maduración de los endosomas. Se puede formar a partir de PI(3,4,5)P3, PI(3,4)P2, o por quinasas desde fosfoinosítidos. Entre las quinasas está la Vps34, la cual se asocia con los endosomas tempranos. Las proteínas que participan en la maduración de los endosomas tienen lugares de unión para el PI(3)P. PI(3)P va siendo degradado a medida que maduran los endosomas y una vez que éstos han reclutado una importante maquinaria proteica. La degradación ocurre por varios mecanismos, siendo uno de ellos la fosforilación, convirtiéndose en PIP(3,5)P2, que es un marcador de endosomas tardíos. Por último, en los cuerpos multivesiculares PI(3)P es forzado a formar parte de las vesículas internas. El ácido lisofosfatídico se produce también en los endosomas en maduración. Este lípido favorece la formación de las vesículas internas.
-
Bibliografía ↷
-
Bibliografía
Alberts A, Johnson A, Lewis J, Raff M, Roberts K, Walter P. 2007. Molecular Biology of the Cell. 5th editon. Garlan Science. ISBN: 9780815341055.
Becker WM, Kleinsmith LJ, Hardin J, Raasch J. 2003. The world of the cell. 6th. San Francisco: Benjamin Cummings. ISBN-10: 0321716027 .
Bohdanowicz M, Grinstein S. 2013. Role of phospholipids in endocytosis, phagocytosis, and macropinocytosis. Physiological reviews. 93: 69-106.
Carquin M, D’Auria L, Pollet H, Bongarzone ER, X Tyteca D. 2016. Recent progress on lipid lateral heterogeneity in plasma membranes: from rafts to submicrometric domains. Progress in lipid research. 62:1-24.
Edidin M. 2003. Lipids on the frontier: a century of cell-membrane bilayers. Nature reviews in molecular and cell biology. 4: 414-418.
Funai K, Summers SA, Rutter J. 2020. Reign in the membrane: How common lipids govern mitochondrial function. Current opinion in cell biology. 63: 162-173.
Drin, G. 2014. Topological regulation of lipid balance in cells. Annual review of biochemistry. 83: 51-77.
Hammond GRV, Burke JE. 2020. Novel roles of phosphoinositides in signaling, lipid transport, and disease. Current opinion in cell biology. 3: 57-67.
Holthuis JCM, Menon AK. 2014. Lipid landscapes and pipelines in membrane homeostasis. Nature. 510: 48-57.
Ikonen E, Zhou X. 2021. Cholesterol transport between cellular membranes: balancing act between interconnected lipid fluxes. Developmental cell. 56: 1430-1436.
Lev S. 2010. Non-vesicular lipid transport by lipid-transfer proteins and beyond. Nature reviews in molecular and cell biology. 11: 739-750.
Nicolson GL. 2014. The Fluid—Mosaic Model of Membrane Structure: Still relevant to understanding the structure, function and dynamics of biological membranes after more than 40years. Biochimica et Biophysica Acta (BBA)-Biomembranes. 1838(6): 1451-1466.
Pollard TD, Earnshaw WC, Lippincott-Schwartz J. 2007. Cell biology. 2th edition. Saunders Elsevier Inc. ISBN: 978-1-4160-2255-8.
Quazi F, S. Molday RS. 2011. Lipid transport by mammalian ABC proteins. Essays in biochemistry. 50, 265–290.
Schenkel LG, Bakovic M. 2014. International journal of cell biology. Article ID 709828, 13 pages.
Schrader M, Godinho LF, Costello JL, Islinger M. 2015. The different facets of organelle interplay—an overview of organelle interactions. Frontiers in cell biology 254: 151-213.
Subczynski WK, Pasenkiewicz-Gierula M, Widomska J, Mainali L, Raguz M. (2017). High cholesterol/low cholesterol: effects in biological membranes: a review. Cell biochemstry and biohysic. 75: 369-385.
Thelen AM, Zoncu R. 2013. Emerging roles for the lysosome in lipid metabolism. Trends in cell biology. 27: 833-850.
Tidhar R, Futerman AH. 2013. The complexity of sphingolipid biosynthesis in the endoplasmic reticulum. Biochimica et biophysica acta. 1833: 2511–2518.
Vance JE. 2014. Phospholipid synthesis and transport in mammalian cells. Traffic, 2014:709828. doi: 10.1155/2014/709828.
van Meer, de Kroon AIPM. 2011. Lipid map of the mammalian cell. Journal of cell biology. 124: 5-8.
Voeltz GK, Sawyer EM, Hajnóczky G, Prinz WA. 2024. Making the connection: how membrane contact sites have changed our view of organelle biology. Cell. 187: 257-270. DOI: 10.1016/j.cell.2023.11.040.
-
 Membrana celular
Membrana celular 